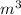Объяснение:
4. PV=(m/M)*R*T - уравнение Менделеева-Клапейрона
По-условию P=const, V=const
V=(m*R*ΔT)/P*M, т.е. прямая зависимость между объёмом и изменением температуры: при увеличении температуры - увеличивается объём
ρ=m/V
PVM=mRT
m/V=PM/RT => ρ=PM/RT, обратная зависимость, т.е. при увеличении температуры - уменьшается плотность.
E=3/2*k*T: опять таки прямая зависимость, т.е. при увеличении температуры - внутренняя энергии растёт.
5. U=3/2*m/M*R*T - первый закон термодинамики
U=PV (из формулы Менделеева-Клапейрона PV=3/2*m/M*R*T)
Отсюда U=PM/ρ => ρ=PM/U
ρ=(96**8*)/4*=192 г/
Объяснение:
4. PV=(m/M)*R*T - уравнение Менделеева-Клапейрона
По-условию P=const, V=const
V=(m*R*ΔT)/P*M, т.е. прямая зависимость между объёмом и изменением температуры: при увеличении температуры - увеличивается объём
ρ=m/V
PVM=mRT
m/V=PM/RT => ρ=PM/RT, обратная зависимость, т.е. при увеличении температуры - уменьшается плотность.
E=3/2*k*T: опять таки прямая зависимость, т.е. при увеличении температуры - внутренняя энергии растёт.
5. U=3/2*m/M*R*T - первый закон термодинамики
U=PV (из формулы Менделеева-Клапейрона PV=3/2*m/M*R*T)
Отсюда U=PM/ρ => ρ=PM/U
ρ=(96*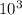 *8*
*8*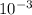 )/4*
)/4*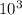 =192 г/
=192 г/