1) Термин SN2 применяется для
А) Реакции сольватации
В) Реакции электрофильного присоединения
C) Реакции мономолекулярного нуклеофильного замещения
D) Реакции бимолекулярного нуклеофильного замещения
2) Какое положение удовлетворяет реакции бимолекулярного нуклеофильного
замещения SN2 с участием алкилгалогенида?
A) Первый порядок по AlkX, нулевой порядок по нуклеофилу, нулевой общий
порядок
B) Первый порядок по AlkX, первый порядок по нуклеофилу, нулевой общий
порядок
C) Первый порядок по AlkX, первый порядок по нуклеофилу, первый общий
порядок
D) Первый порядок по AlkX, первый порядок по нуклеофилу, второй общий
порядок
E) Второй порядок по AlkX, нулевой порядок по нуклеофилу, второй общий
порядок
3) Рассмотрите реакцию нуклеофильного замещения между метилбромидом и
гидроксидом калия. Как изменится скорость реакции, если концентрации реагентов
увеличить в 2 раза?
A) Изменений не будет
B) Скорость увеличится в 2 раза
C) Скорость увеличится в 4 раза
D) Скорость увеличится в 8 раз
E) Скорость увеличится в 16 раз
4) Геометрией переходного состояния в SN2 реакции является
A) Планарная тригональная
B) Тетраэдрическая
C) Пентагональная
D) Тригональная бипирамидальная
E) Октаэдрическая
5) В SN2 реакции нуклеофил подходит к акилгалогениду
A) Все равно, как
B) Со стороны связи углерод-галоген
C) Со стороны, обратной связи углерод-галоген
6) Рассмотрите механизм реакции трет-бутилхлорида с иодид-ионом.
(CH3)3C Cl + I (CH3)3C I + Cl
Выберите правильный ответ на следующий во если концентрацию иодид-иона
удвоить, то скорость образования трет-бутилиодида.
(A) Увеличится в 2 раза
(B) Увеличится в 4 раза
(C) Останется той же самой
(D) Уменьшится
(E) Ни один из этих ответов
Хранение проб, в том числе содержащих следовые количества анализируемых веществ, осложнено проблемой их потерь за счет сорбции на стенках сосудов, а также разрушения в растворителях и на поверхностях носителей под действием кислорода, света и других факторов внешней среды. В воде протекают процессы окисления-восстановления (чаще окисления из-за наличия в воде растворенного кислорода), биохимические процессы с участием бактерий и других живущих в ней биообъектов, а также физические и физико-химические процессы сорбции, седиментации и др. В водных растворах, например, нитраты в присутствии органики могут восстанавливаться до нитритов или даже до ионов аммония (а в отсутствии органики эти процессы могут идти в обратную сторону из-за наличия в воде растворенного кислорода), а сульфаты - до сульфитов. Сам растворенный кислород может расходоваться на окисление этих органических веществ. Соответственно могут изменяться и органолептические свойства воды - запах, вкус, цвет, мутность.Для этого используют различные применение максимально инертной (соответствующей свойствам веществ) посуды; приемы «захолаживания» и затемнения пробы; обработку (продувку) ее инертными газами; предварительное насыщение рабочих поверхностей веществом, аналогичным анализируемому («тренировка» поверхностей); введение дополнительных веществ-стабилизаторов и т.д. Стараются также максимально сокращать время хранения и доставки проб, так как применение консервирующих средств полностью не предохраняет определяемое вещество или саму среду от изменений. Поэтому стараются даже консервированные пробы анализировать сразу или на следующий день, но не позднее, чем на третьи сутки после отбора пробы. При этом консервация сточных вод вообще весьма затруднительна. Но тем не менее, данный технологический прием применяется довольно часто.В случае «обычных», наиболее часто загрязняющих воду веществ применяются довольно простые и давно проверенные консервации и хранения проб, примеры которых описаны в оригинальном Руководстве по экспресс-анализу воды полевыми методами . Консервация проб воды, как уже отмечалось ранее, преследует цель сохранения компонентов, определяемых в ней, и свойств воды в том состоянии, в котором она находилась в момент взятия пробы.
Однако при добавлении к водным пробам их стабилизаторов всегда необходимо всесторонне учитывать их свойства и те осложнения, которые могут возникнуть при анализе из-за применения консервирующих добавок. Так, например, известно, что для предотвращения коагуляции крови к ней очень часто добавляют кислоту (ЭДТА), которая связывает тяжелые металлы.
V(CH₄) = 12,22 дм³
Объяснение:
Мендлеева-Клапейрона и оно имеет следующий вид:
Так как нам даны и химические величины и физические, то уравнение, которое объединяет и химическое количество, и объем, и давление - уравнение Менделеева-Клайперона которое имеет следующий вид:
pV=nRT где p - давление, V - объем, n - химическое количество, R - газовая постоянная и Т - температура в Кельвинах.
Выразим из уравнения искомый объем -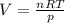 .
.
Так, переведем сразу же градусы в Кельвины: 25°С + 273.15= 298.15K
И переведем постоянную газовую, которая равна при именно атмосферном давлении - 0,082 атм·дм³/K·моль
Теперь, приведя все данные к одним размерностям можем расчитать сам объем метана -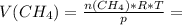 1 моль·0,082атм·дм³/K·моль· 298.15K ÷ 2атм = 12,22 дм³
1 моль·0,082атм·дм³/K·моль· 298.15K ÷ 2атм = 12,22 дм³