1. Укажите формулы оксидов неметаллов 1) NO
2) Li2O
3) BaO
4) BeO
5) SO2
2. Укажите формулы соответственно кислоты и растворимой соли
1) H3N
2) HClO2
3) K2SO3
4) MgCO3
5) Ca3P2
3. Укажите формулы солей – нитрат и сульфид
1) Na2SO4
2) BaS 3) Ca(NO2)2
4) Al(NO3)3
5) H2S
4. Укажите формулы солей – хлорид и карбонат
1) HCl
2) FeCl3 3) H2SO3
4) BaCO3
5) CH4
5. Укажите формулы соответственно сульфата железа (III) и гидроксида кальция
1) FeS
2) KOH
3) Fe2(SO4)3
4) FeSO4
5) Ca(OH)2
6. Укажите формулы соответственно соли и оксида
1) Li3N
2) MnO2
3) NaOH
4) CuSO4
5) HNO3
ответами к заданиям 7-10 является развернутый ответ.
7. Составить уравнения химических реакций. Расставить коэффициенты.
Mg + O2 → As + O2 →
Na + H2 → H2 + N2 →
ZnO + H2 → Al2S3 + O2 →
Cr2O3 + H2 → C3H6 + O2 →
8. К 240 г 10% раствора хлорида натрия добавили 20 г вещества. Определите массовую долю соли в новом растворе. ответ укажите с точностью до целых.
9. Определите массу 18 л оксида углерода (IV) при н.у. ответ укажите с точностью до сотых.
10. Задача по химическому уравнению. Определите массу оксида фосфора (V), который образуется при взаимодействии 31г фосфора с кислородом.
Составитель: Маланина Е. А. учитель химии, МБОУ Одинцовская гимназия № 13, Московская область
Контрольная работа № 2 – 8 класс Тема «Важнейшие представители неорганических веществ.
Количественные отношения в химии» Вариант 2
ответами к заданиям 1-6 является последовательность цифр.
1. Укажите формулы оксидом металлов
1) NiO
2) Cl2O
3) Br2O7
4) BaO
5) SeO2
2. Укажите формулы соответственно основания и нерастворимой соли
1) Sr(OH)2
2) H3PO4
3) NaNO3
4) Ca3(PO4)2
5) SiH4
3. Укажите формулы солей – фосфат и карбонат
1) Li3PO3
2) Al(OH)3
3) Al4C3
4) CaCO3
5) K3PO4
4. Укажите формулы солей – нитрит и сульфат
1) MgSO3
2) FeSO4
3) KNO2
4) Ca(NO3)2
5) Na3N
5. Укажите формулы соответственно сульфита калия и нитрата железа (II)
1) Fe(NO3)3
2) K2SO4
3) K2SO3
4) Fe2(NO3)2
5) K2S
6. Укажите формулы основания и кислоты
1) Cu2O
2) Co(OH)2
3) HMnO4
4) K2Cr2O7
5) H2O
ответами к заданиям 7-10 является развернутый ответ.
7. Составить уравнения химических реакций. Расставить коэффициенты.
Li + O2 → N2 + O2 →
Ca + H2 → H2 + F2 →
PbO + H2 → MnS + O2 →
TiO2 + H2 → C2H6 + O2 →
8. К 180 г 5% раствора бромида калия добавили 120 г воды. Определите массовую долю соли в новом растворе. ответ укажите с точностью до целых.
9. Определите объем при н.у. 40 г оксида азота (III). ответ укажите с точностью до сотых.
10. Задача по химическому уравнению. Определите массу оксида железа (III), который образуется при взаимодействии 28г железа с кислородом.
В круглых скобках указано название вещества ()
1)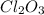 (оксид хлора(3)); Валентность: у хлора - 3, у кислорода - 2.
(оксид хлора(3)); Валентность: у хлора - 3, у кислорода - 2.
2)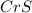 (сульфид хрома(2)); Валентность: у хрома 2, у серы 2, поэтому индексы не нужны.
(сульфид хрома(2)); Валентность: у хрома 2, у серы 2, поэтому индексы не нужны.
3)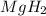 (гидрид магния); Валентность: у магния 2, у водорода - 1.
(гидрид магния); Валентность: у магния 2, у водорода - 1.
4)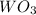 (оксид вольфрама(3)); Валентность: у вольфрама - 6, у кислорода 2.
(оксид вольфрама(3)); Валентность: у вольфрама - 6, у кислорода 2.
5)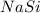 (силицид натрия); Валентность: у натрия - 1, у кремния - 1.
(силицид натрия); Валентность: у натрия - 1, у кремния - 1.
6)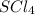 (хлорид серы(4)); Валентность: у серы - 4, у хлора 1.
(хлорид серы(4)); Валентность: у серы - 4, у хлора 1.
7)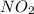 (оксид азота(4)); Валентность: у азота - 4, у кислорода - 2.
(оксид азота(4)); Валентность: у азота - 4, у кислорода - 2.
8)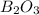 (оксид брома); Валентность: у брома - 3, у кислорода - 2.
(оксид брома); Валентность: у брома - 3, у кислорода - 2.
Сырьем для производства чугуна служат железная руда и кокс, то есть чистый углерод, полученный при коксовании каменного угля – его разложении без доступа воздуха. В качестве железной руды обычно используют железняки – магнитный Fe3O4, красный Fe2O3, бурый Fe2O3×xH2O.
Выплавку чугуна производят в домнах – больших печах, высотой до 80 м, выложенных изнутри огнеупорным кирпичом, а сверху покрытых стальным кожухом. Сверху в доменную печь непрерывно загружают руду и кокс, а снизу подают горячий воздух, обогащенный кислородом. В основе получения железа из руды лежат реакции восстановления оксидов углем и угарным газом СО – продуктом его неполного окисления:
Fe2O3+3C=2Fe+3CO
Fe2O3+3CO=2Fe+3CO2
В верхней части печи температура достигает 2000°C. В расплавленном железе, образовавшемся при восстановлении руды, растворяется углерод, частично взаимодействуя с ним с образованием карбида – цементита Fe3C. Так образуется чугун.
Для передела его в сталь излишний углерод необходимо выжечь – окислить кислородом. Это осуществляют в сталеплавильном цехе. Однако при пропускании кислорода через расплавленный чугун часть железа также окисляется кислородом до оксида:
2Fe+O2=2FeO
Для обратного восстановления оксида железа(II) до металла в расплав вводят раскислители, как правило, это марганец, барий, кальций, лантан. Они и восстанавливают окислившееся железо:
Mn+FeO=MnO+Fe
а затем отделяются от расплава, всплывая на его поверхность в виде легкоплавких шлаков.
Объяснение: