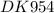2.12. найти изменение энтропии при охлаждении 40 г пара метановой кислоты (сн2о2) от 120 до -10°с. удельная теплота плавления – 772 дж/г, парообразования – 1365 дж/г, удельная теплоемкость – срг = 5,6 дж/г∙к, сртв = 7,6 дж/г∙к, температура плавления – 8,50с, кипения – 120°с
Дано:
T = 293 К
[Ca²⁺] = 70 моль/л
Найти:
E(Ca²⁺/Ca) - ?
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
ответ: E(Ca²⁺/Ca) = -2,85 В
Решено от :