6. Обчисліть відносну густину. а) хлору за повітрямс б) амоніаку NH за киснем, в) пропану СН за хором г) вуглекислого газу со за по- вітрямд) амоніаку Nң, за воднем е брчистого газу ѕ0 за озоном е капано за азотом N, ж) метану он за хлором а
2) орг-е в-во сод-т C, H и возможно O; n C = n CO2 = 5.376/22.4 = 0.24 моль (масса C = 12*0.24 = 2.88 г), n H = 2*n H2O = 2*(5.4/18) = 0.6 моль (масса H = 0.6 г);
3) суммарная масса C+H = 2.88+0.6 = 3.48 г, след-но 5.4-3.48 = 1.92 г прих-ся на O кол-м в-ва соот-но 1.92/16 = 0.12 моль;
4) т.о. простейшая ф-ла орг-го в-ва C0.24H0.6O0.12 или C2H5O (M = 45 г/моль), а истинная равна 90/45 = 2*(C2H5O) = C4H10O2 (это м.б. например один из изомерных бутандиолов).
В одну стадию нельзя получить этиленгликоль из этанола, поэтому в каждом несколько реакций.
1. Получение по цепочке этанол ⇒ хлорэтан ⇒ винилхлорид ⇒ 1,2-дихлорэтан ⇒ этиленгликоль.
1. Реакция взаимодействия этанола с хлороводородом:
ᅠᅠ
2. Реакция дегидрирования хлорэтана при нагревании и в присутствии Никеля:
ᅠᅠ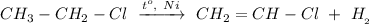
3. Реакция присоединения хлороводорода против правила Марковникова в присутствии пероксида водорода:
ᅠᅠ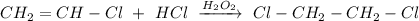
4. Щелочной гидролиз 1,2-дихлорэтана при нагревании водным раствором щёлочи, получаем этиленгликоль:
ᅠᅠ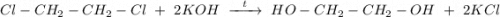
2. Получение по цепочке этанол ⇒ этен ⇒ эпоксид этилена ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ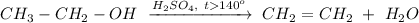
2. Реакция окисления этилена кислородом воздуха в присутствии ионов серебра:
ᅠᅠ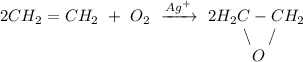
3. Гидролиз эпоксида в кислой среде при нагревании, получение этиленгликоля:
ᅠᅠ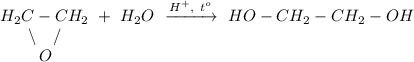
3. Получение по цепочке этанол ⇒ этилен ⇒ этиленгликоль.
1. Реакция внутримолекулярной дегидратации этанола при нагревании свыше 140 градусов и в присутствии концентрированной серной кислоты:
ᅠᅠ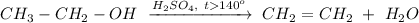
2. Реакция окисления этилена перманганатом калия в нейтральной среде при температуре в 0 градусов:
1) М орг-го в-ва сос-т 45*2 = 90 г/моль;
2) орг-е в-во сод-т C, H и возможно O; n C = n CO2 = 5.376/22.4 = 0.24 моль (масса C = 12*0.24 = 2.88 г), n H = 2*n H2O = 2*(5.4/18) = 0.6 моль (масса H = 0.6 г);
3) суммарная масса C+H = 2.88+0.6 = 3.48 г, след-но 5.4-3.48 = 1.92 г прих-ся на O кол-м в-ва соот-но 1.92/16 = 0.12 моль;
4) т.о. простейшая ф-ла орг-го в-ва C0.24H0.6O0.12 или C2H5O (M = 45 г/моль), а истинная равна 90/45 = 2*(C2H5O) = C4H10O2 (это м.б. например один из изомерных бутандиолов).
Объяснение: