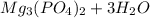Амин получается при взаимодействии: Выберите один из 4 вариантов ответа: 1) бромида диметилэтиламмония с водным раствором щёлочи 2) аммиака с хлороводородом 3) этанола и водорода 4) хлорангидрида уксусной кислоты и метиламина
Видим, что степени окисления численно разные ( 2 и 1).
Следовательно ко-во плюсов и минусов неравно. Нехорошо. Поэтому мы ставим индексы (маленькие цифры снизу), чтобы уровнять эти плюсы и минусы.
Как?
Находим такое наименьшее число, которое будет делится на обе степени окисления. Это 2.
2 делим на степ окисл Na⁺¹ (2:1=2) индекс натрия 2 .
2 делим на степ окисл SO₄⁻² (2:2=1) индекс кислотного остатка 1 . Вот и получилось Na⁺¹₂(SO₄)⁻²
2. Возьмем кислоту H₂S (cероводородная)
здесь еще проще
у водорода ВСЕГДА +1 за исключением случаем с металлами (тк металлы не меняют никогда, а водород все таки может уступить K⁺H⁻ гидрид калия)
у кислотного остатка так же смотрим в табл растворимости ⁻²
H⁺₂S⁻²
помня правило, ставим у водорода индекс ₂
Другая кислота Н₂CO₃
у водорода ⁺¹
у кислотного остатка СО₃⁻²
3. Основания к примеру NaOH
Na металл первой группы значит степень окисления ⁺¹
ОН гидроксогруппа ВСЕГДА без исключений ⁻¹
Na⁺¹(OH)⁻¹ сделала в скобочки, чтобы было видно, что ОН это одно целое, а вообще здесь скобки не нужно
Al(OH)₃
Al металл 3 группы, значит степень окисления ⁺³
гидроксогруппа всегда ⁻¹
Al⁺³(OH)⁻¹₃ чтобы уравнять кол-во плюсиков и минусиков ставим индекс
4. Оксиды Состоят из металла\неметалла+ кислород
кислород в оксидах и всегда ⁻²
Li₂O
кислород ⁻²
литий металл 1 группы значит ⁺¹
Li⁺¹₂O⁻² ставим индекс 2 у лития, чтобы уровнять кол-во + и -
Помнишь наше вещество Na₂SO₄? Мы уже знаем, что у Na⁺¹ , а у кисл ост SO₄⁻². Но этого достаточно только для того, чтобы расставить индексы в молекуле.
Если мы хотим знать степень окисления серы S в этом веществе, то, помня правило, о том, что плюсики равны минусикам, смотрим
Na₂SO₄
Na⁺¹ (но натрия ту два, тк стоит индекс 2, следовательно и плюса 2)
O⁻² (помним, что у кислорода всегда ⁻², если рассматриваем его отдельно от кисл остатка, но кислорода у нас (смотрим в молекулу) 4, значит минусика (2*4=8)
итак, плюсов 2
минусов 8
не хватает 6 плюсов для равновесия. значит степень окисления серы здесь ⁺⁶
сера может менять степени окисления
нужно уметь понимать, когда мы находим степ окисл кислотного остатка SO₄ например, а когда чистого атома S в молекуле.
Еще важное правило
Посмотрим на реакцию
Fe⁰+H⁺¹Cl⁻¹=Fe⁺²Cl⁻¹₂+H⁰₂ (не уравнено, чтобы не мешались коэффициенты)
С H⁺¹Cl⁻¹ и Fe⁺²Cl⁻¹₂ все более менее понятно (кстати железо Fe имеет две степени окисления ⁺² и ⁺³, но здесь ⁺²)
Почему у железа и водорода степени окисления ⁰ ?
Потому что это простые вещества, то есть те, которые состоят из одного элемента. Здесь Fe ни с чем не связан в молекуле, только сам по себе, значит ⁰ . У водорода тоже самое, несмотря на то что стоит индекс H₂, вещество простое, т к всего один элемент-водород.
А индекс указывает на то, что это неметалл, но не все неметаллы имеют индексы)
Простые вещества (примеры):
Сl₂⁰ Br₂⁰ I₂⁰ H₂⁰ O₂⁰ S⁰ S₈⁰(бывает) Fe⁰ Al⁰ Mg⁰
но когда эти вещества с чем то в молекуле находятся, то перестают быть простыми и имеют уже степ окисл соответственно правилам
1. а)У калия б)У натрия (металлические свойства увеличиваются по периоды справа налево, а в группе сверху вниз )
2.Si - кремний
а)IVа группа 3 период
б)+14 Si )2)8)4
в) - кислотный, не растворяется в воде
- кремниевая кислота, малорастворима в воде
3.Металлические(восстановительные), основные свойства усиливаются слева направо (←), неметаллические(окислительные) и кислотные свойства усиливаются справа налево (→), также электроотрицательность усиливается справа налево (→), радиус атома увеличивается слева направо (←)
Здесь равно, все в порядке
Другая соль Na₂SO₄
металл натрий находится в первой группе, его степень окисления ⁺¹
кислотный остаток SO₄ (cмотрим табл растворимости слева) ⁻²
Na⁺¹₂(SO₄)⁻²
Видим, что степени окисления численно разные ( 2 и 1).
Следовательно ко-во плюсов и минусов неравно. Нехорошо. Поэтому мы ставим индексы (маленькие цифры снизу), чтобы уровнять эти плюсы и минусы.
Как?
Находим такое наименьшее число, которое будет делится на обе степени окисления. Это 2.
2 делим на степ окисл Na⁺¹ (2:1=2) индекс натрия 2 .
2 делим на степ окисл SO₄⁻² (2:2=1) индекс кислотного остатка 1 . Вот и получилось Na⁺¹₂(SO₄)⁻²
2. Возьмем кислоту H₂S (cероводородная)
здесь еще проще
у водорода ВСЕГДА +1 за исключением случаем с металлами (тк металлы не меняют никогда, а водород все таки может уступить K⁺H⁻ гидрид калия)
у кислотного остатка так же смотрим в табл растворимости ⁻²
H⁺₂S⁻²
помня правило, ставим у водорода индекс ₂
Другая кислота Н₂CO₃
у водорода ⁺¹
у кислотного остатка СО₃⁻²
3. Основания к примеру NaOH
Na металл первой группы значит степень окисления ⁺¹
ОН гидроксогруппа ВСЕГДА без исключений ⁻¹
Na⁺¹(OH)⁻¹ сделала в скобочки, чтобы было видно, что ОН это одно целое, а вообще здесь скобки не нужно
Al(OH)₃
Al металл 3 группы, значит степень окисления ⁺³
гидроксогруппа всегда ⁻¹
Al⁺³(OH)⁻¹₃ чтобы уравнять кол-во плюсиков и минусиков ставим индекс
4. Оксиды Состоят из металла\неметалла+ кислород
кислород в оксидах и всегда ⁻²
Li₂O
кислород ⁻²
литий металл 1 группы значит ⁺¹
Li⁺¹₂O⁻² ставим индекс 2 у лития, чтобы уровнять кол-во + и -
Помнишь наше вещество Na₂SO₄? Мы уже знаем, что у Na⁺¹ , а у кисл ост SO₄⁻². Но этого достаточно только для того, чтобы расставить индексы в молекуле.
Если мы хотим знать степень окисления серы S в этом веществе, то, помня правило, о том, что плюсики равны минусикам, смотрим
Na₂SO₄
Na⁺¹ (но натрия ту два, тк стоит индекс 2, следовательно и плюса 2)
O⁻² (помним, что у кислорода всегда ⁻², если рассматриваем его отдельно от кисл остатка, но кислорода у нас (смотрим в молекулу) 4, значит минусика (2*4=8)
итак, плюсов 2
минусов 8
не хватает 6 плюсов для равновесия. значит степень окисления серы здесь ⁺⁶
сера может менять степени окисления
нужно уметь понимать, когда мы находим степ окисл кислотного остатка SO₄ например, а когда чистого атома S в молекуле.
Еще важное правило
Посмотрим на реакцию
Fe⁰+H⁺¹Cl⁻¹=Fe⁺²Cl⁻¹₂+H⁰₂ (не уравнено, чтобы не мешались коэффициенты)
С H⁺¹Cl⁻¹ и Fe⁺²Cl⁻¹₂ все более менее понятно (кстати железо Fe имеет две степени окисления ⁺² и ⁺³, но здесь ⁺²)
Почему у железа и водорода степени окисления ⁰ ?
Потому что это простые вещества, то есть те, которые состоят из одного элемента. Здесь Fe ни с чем не связан в молекуле, только сам по себе, значит ⁰ . У водорода тоже самое, несмотря на то что стоит индекс H₂, вещество простое, т к всего один элемент-водород.
А индекс указывает на то, что это неметалл, но не все неметаллы имеют индексы)
Простые вещества (примеры):
Сl₂⁰ Br₂⁰ I₂⁰ H₂⁰ O₂⁰ S⁰ S₈⁰(бывает) Fe⁰ Al⁰ Mg⁰
но когда эти вещества с чем то в молекуле находятся, то перестают быть простыми и имеют уже степ окисл соответственно правилам
если что-нибудь нужно спросить, спрашивайте
1. а)У калия б)У натрия (металлические свойства увеличиваются по периоды справа налево, а в группе сверху вниз )
2.Si - кремний
а)IVа группа 3 период
б)+14 Si )2)8)4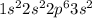
в)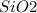 - кислотный, не растворяется в воде
- кислотный, не растворяется в воде
3.Металлические(восстановительные), основные свойства усиливаются слева направо (←), неметаллические(окислительные) и кислотные свойства усиливаются справа налево (→), также электроотрицательность усиливается справа налево (→), радиус атома увеличивается слева направо (←)
4. 12-Магний (Mg) 15-Фосфор (P)
MgO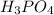
3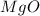 +2
+2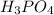 =
=