Химия, 10 класс задача У кроликов серая окраска шерсти доминирует над белой, ангорская шерсть доминирует над обычной. Определите генотип и фенотип потомства от скрещивания дигетерозиготных особей, если сочетание ВВ приводит к гибели потомства.
Если посмотреть на график (смотри фото) зависимости растворимости от температуры,то можно наблюдать,что для вещества AgNO3, с увеличением температуры - возрастаёт растворимость в воде (зелёная линия).На графике по оси абсцисс отложена температура, по оси ординат - растворимость в 100г воды. Соответственно, находим температуру 10 грусов и ведём до пересечения с зелёной линией,далее проведя влево находим растворимость,которая составляет 176г на 100г воды при 10 градусах.
Так как нам нужно приготовить насыщенный раствор с массой 250г (а у нас получается ,что сумма 100г воды + 176г соли = 276г), то соответственно необходим пересчет на 250г. Для того чтобы раствор был насыщенный,необходимо поддерживать,такую же концентрацию(или соотношение соль:вода) в растворе т.е. w(AgNO3)=176/276=0.638 (или соотношение соль:вода=176:100).
Тогда в 250г насыщенного раствора при 10 градусах должно быть соли 250*0.638=159.5г и воды 250-159.5=90.5г.
ответ: для приготовления насыщенного раствора массой 250г при 10 градусах нужно взять 159.5г AgNO3 и 90.5г воды.
2.Решение:
Для решения данной задачи снова обратимся к гафику растворимости (смотри фото) и находим голубую линию.
Из условий сказано ,что насыщенный раствор был приготовлен при 90 градусах, соответственно растворимость при такой температуре составляет 68г на 100г воды.Т.к. насыщенный раствор готовили в 400г воды,то для приготовления насыщенного раствора в 400г воды нужно соли m(CuSO4)=68*4=272г.
Чтобы узнать сколько соли выпадет,найдем растворимость при 10 градусах - равна 18г на 100г воды ( в 400г соответственно 18*4=72г )Тогда при охлаждении с 90 градусов до 10 в осадок выпадет 272-72=200г соли.
Массовая доля меди в насыщенном растворе при 10 градусах будет равна:
w(CuSO4)=72/472*100%=15.25%
ответ: в осадок выпадет 200г соли при охлаждении; массовая доля сульфата меди а растворе при 10градусах равна 15.25%.
1.Решение:
Если посмотреть на график (смотри фото) зависимости растворимости от температуры,то можно наблюдать,что для вещества AgNO3, с увеличением температуры - возрастаёт растворимость в воде (зелёная линия).На графике по оси абсцисс отложена температура, по оси ординат - растворимость в 100г воды. Соответственно, находим температуру 10 грусов и ведём до пересечения с зелёной линией,далее проведя влево находим растворимость,которая составляет 176г на 100г воды при 10 градусах.
Так как нам нужно приготовить насыщенный раствор с массой 250г (а у нас получается ,что сумма 100г воды + 176г соли = 276г), то соответственно необходим пересчет на 250г. Для того чтобы раствор был насыщенный,необходимо поддерживать,такую же концентрацию(или соотношение соль:вода) в растворе т.е. w(AgNO3)=176/276=0.638 (или соотношение соль:вода=176:100).
Тогда в 250г насыщенного раствора при 10 градусах должно быть соли 250*0.638=159.5г и воды 250-159.5=90.5г.
ответ: для приготовления насыщенного раствора массой 250г при 10 градусах нужно взять 159.5г AgNO3 и 90.5г воды.
2.Решение:
Для решения данной задачи снова обратимся к гафику растворимости (смотри фото) и находим голубую линию.
Из условий сказано ,что насыщенный раствор был приготовлен при 90 градусах, соответственно растворимость при такой температуре составляет 68г на 100г воды.Т.к. насыщенный раствор готовили в 400г воды,то для приготовления насыщенного раствора в 400г воды нужно соли m(CuSO4)=68*4=272г.
Чтобы узнать сколько соли выпадет,найдем растворимость при 10 градусах - равна 18г на 100г воды ( в 400г соответственно 18*4=72г )Тогда при охлаждении с 90 градусов до 10 в осадок выпадет 272-72=200г соли.
Массовая доля меди в насыщенном растворе при 10 градусах будет равна:
w(CuSO4)=72/472*100%=15.25%
ответ: в осадок выпадет 200г соли при охлаждении; массовая доля сульфата меди а растворе при 10градусах равна 15.25%.
оксид серы (VI)
кислотный оксид
Степень окисления кислорода, как в любом оксиде, равна -2.
Степень окисления серы равна +6;
нитрат меди (II)
соль, имеет кисоую реакцию, так как гидролизуется по катиону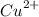 , как соль, образованная слабым основанием
, как соль, образованная слабым основанием 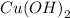 и сильной кислотой
и сильной кислотой 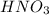 .
.
Cтепень окисления меди равна +2, степень окисления азота равна +5, степень окисления кислорода равна -2.
хлорат калия
нейтральная соль, поскольку образована сильными электролитами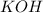 и
и 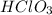
Степени окисления:
калий +1
хлор +5
кислород -2
фосфористая кислота, слабая
Степени окисления:
водород +1
фосфор +3
кислород -2