Как распознать три раствора - mgcl2, nh4no3, koh, если даны следующие реактивы для распознавания - agno3, cu, fecl3, bao,nacl. составить план и выполнить действия по этому плану.
Для начала ищем главную углеродную цепь (УЦ) — она состоит из наибольшего числа атомов углерода (выделена красным цветом). Далее нумеруем атомы углерода в УЦ — наша УЦ состоит из 7 атомов углерода ("гепт"). Далее смотрим на радикалы. В нашем случае здесь 2 вида радикала — метил — (выделен синим цветом) и этил — (выделен зелёным цветом). 2 радикала метила связаны со втором атомом углерода, а один с 6. 2 радикала этила связаны с 4 и 5 атомами углерода.
Итак, всё выше перечисленное будет отображаться в названии вещества.
Сначала в названии вещества пишем те номера атомов углерода, с которым связан метил — 2,2,6-триметил ("три" потому что всего три радикала метила). Потом пишем номера тех атомов углерода, которые связаны с этилом — 4,5-диэтил ("ди" потому что всего два радикала этила). В конце пишем "гептан" ("гепт" потому что УЦ состоит из 7 атомов углерода, окончание "ан" потому что все связи между атомами углерода одинарные).
Тема урока: Фосфор: физические и химические свойства.
1.Вставьте пропуски: фосфор - элемент 3 периода, 5 группы, на его внешнем энергетическом уровне 5 электронов, высшая валентность 5, низшая валентность 3, высшая степень окисления +5, низшая степень окисления -3. Возможные соединения (дать им название) с данными степенями окисления P4O10.
2.Заполнить таблицу физические свойства фосфора:
Аллотропные атомная, молекулярная крист. решетка
видоизменения фосфора Физическое состояние твердый Схема строения в зависимости от аллотропной модификации
(фрагмент) Цвет Красный/синий/фиолетовый/черный Растворимость в воде реагирует с водой Температура плавления 44,15 Свечение Зеленый(в темноте) Действие на организм Красный при хроническом действии вызывает пневмонию, белый крайне токсичен Т воспламенения
Белый
48
Красный
240
Черный
490
3. Фосфор в природе:
В свободном состоянии в природе не встречается. Важнейшие минералы апатит, фосфорит В составе живых организмов в виде в составе нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов
4.Запишите уравнения реакций получения фосфора:
4HPO3 + 10C -> P4 + 2H2O + 10CO
5.Запишите уравнения реакций, укажите степени окисления фосфора:
а) взаимодействия фосфора с кальцием 3Ca + 2P(0) -> Ca3P2(+3)
б) взаимодействия фосфора с кислородом 4P(0)+5O2->P4(+5)O10
в) взаимодействия фосфора серой (фосфор проявляет степень окисления +3) 2P(0) + 3S -> P2(+3)S3
г) взаимодействия фосфора с хлором (фосфор проявляет высшую степень окисления) 2P(0) + 5Cl2 -> 2P(+5)Cl5
6. Фосфор применяют в спичках, клее, стекле, хим. оружии и т.д.
7. Решить тест:
1. Электронная формула фосфора:
В. 1S2 2S2 2p6 3S2 3p3
2. Бесцветное или желтоватое кристаллическое вещество, воспламеняется при 400С
Г. белый фосфор
3. Бесцветное твердое кристаллическое вещество:
Б. фосфорная кислота
4. Фосфор встречается в природе:
А. в соединения
5. Установите соответствие между названием вещества и его формулой
н) Это 2,2,6-триметил 4,5-диэтилгептан.
Объяснение :
Для начала ищем главную углеродную цепь (УЦ) — она состоит из наибольшего числа атомов углерода (выделена красным цветом). Далее нумеруем атомы углерода в УЦ — наша УЦ состоит из 7 атомов углерода ("гепт"). Далее смотрим на радикалы. В нашем случае здесь 2 вида радикала — метил — (выделен синим цветом) и этил —
(выделен синим цветом) и этил — 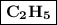 (выделен зелёным цветом). 2 радикала метила связаны со втором атомом углерода, а один с 6. 2 радикала этила связаны с 4 и 5 атомами углерода.
(выделен зелёным цветом). 2 радикала метила связаны со втором атомом углерода, а один с 6. 2 радикала этила связаны с 4 и 5 атомами углерода.
Итак, всё выше перечисленное будет отображаться в названии вещества.
Сначала в названии вещества пишем те номера атомов углерода, с которым связан метил — 2,2,6-триметил ("три" потому что всего три радикала метила). Потом пишем номера тех атомов углерода, которые связаны с этилом — 4,5-диэтил ("ди" потому что всего два радикала этила). В конце пишем "гептан" ("гепт" потому что УЦ состоит из 7 атомов углерода, окончание "ан" потому что все связи между атомами углерода одинарные).
Итог — 2,2,6-триметил 4,5-диэтилгептан.
Поставь лучший ответ , я слишком долго это делал
Тема урока: Фосфор: физические и химические свойства.
1.Вставьте пропуски: фосфор - элемент 3 периода, 5 группы, на его внешнем энергетическом уровне 5 электронов, высшая валентность 5, низшая валентность 3, высшая степень окисления +5, низшая степень окисления -3. Возможные соединения (дать им название) с данными степенями окисления P4O10.
2.Заполнить таблицу физические свойства фосфора:
Аллотропные атомная, молекулярная крист. решетка
видоизменения фосфора Физическое состояние твердый Схема строения в зависимости от аллотропной модификации
(фрагмент) Цвет Красный/синий/фиолетовый/черный Растворимость в воде реагирует с водой Температура плавления 44,15 Свечение Зеленый(в темноте) Действие на организм Красный при хроническом действии вызывает пневмонию, белый крайне токсичен Т воспламенения
Белый
48
Красный
240
Черный
490
3. Фосфор в природе:
В свободном состоянии в природе не встречается. Важнейшие минералы апатит, фосфорит В составе живых организмов в виде в составе нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов
4.Запишите уравнения реакций получения фосфора:
4HPO3 + 10C -> P4 + 2H2O + 10CO
5.Запишите уравнения реакций, укажите степени окисления фосфора:
а) взаимодействия фосфора с кальцием 3Ca + 2P(0) -> Ca3P2(+3)
б) взаимодействия фосфора с кислородом 4P(0)+5O2->P4(+5)O10
в) взаимодействия фосфора серой (фосфор проявляет степень окисления +3) 2P(0) + 3S -> P2(+3)S3
г) взаимодействия фосфора с хлором (фосфор проявляет высшую степень окисления) 2P(0) + 5Cl2 -> 2P(+5)Cl5
6. Фосфор применяют в спичках, клее, стекле, хим. оружии и т.д.
7. Решить тест:
1. Электронная формула фосфора:
В. 1S2 2S2 2p6 3S2 3p3
2. Бесцветное или желтоватое кристаллическое вещество, воспламеняется при 400С
Г. белый фосфор
3. Бесцветное твердое кристаллическое вещество:
Б. фосфорная кислота
4. Фосфор встречается в природе:
А. в соединения
5. Установите соответствие между названием вещества и его формулой
Название:
Формула:
А. фосфор 5.P
Б. фосфид кальция 1. Ca3P2
В. фосфорная кислота 6. H3PO4
Г. гидрофосфат аммония 3. (NH4)2 HPO4
Д. оксид фосфора(V) 4.P2O5
Е фосфин 2. PH3