Електронна оболонка складається з чотирьох енергетичних рівнів. На зовнішньому рівні-2 спарені електрони (4s2 )
Распределение электронов по энергетическим уровням 2) 8) 8) 2)
Электронная формула 1s² 2s²2p⁶ 3s²3p⁶ 4s²
Кальций - типичный щелочно-земельный металл, относится к s-элементам.
Валентность в высшем оксиде и гидроксиде - 2
СаО - оксид кальция и
Сa(OH)₂ - гидроксид кальция проявляют основные свойства
СaO + H₂O = Ca(OH)₂;
CaO + 2HCl = CaCl₂ + H₂O
Ca(OH)₂ + H₂SO₄ = CaSO₄ + 2H₂O
Ca(OH)₂ + 2CO₂ = Ca(HCO₃)₂
Порівняння металічних або неметалічних властивостей із властивостями елементів, що стоять поряд у періоді та групі: Металічні властивості виражені більше, ніж у Берилія й Алюмінію, але менше, ніж у Калія та Стронція
Кальций, химический знак - Са
Кальций находится в IV большом периоде, IIA группы (II группа, главная подгруппа)
Заряд ядра +20, электронов - 20, протонов - 20, нейтронов - 20
Електронна оболонка складається з чотирьох енергетичних рівнів. На зовнішньому рівні-2 спарені електрони (4s2 )
Распределение электронов по энергетическим уровням 2) 8) 8) 2)
Электронная формула 1s² 2s²2p⁶ 3s²3p⁶ 4s²
Кальций - типичный щелочно-земельный металл, относится к s-элементам.
Валентность в высшем оксиде и гидроксиде - 2
СаО - оксид кальция и
Сa(OH)₂ - гидроксид кальция проявляют основные свойства
СaO + H₂O = Ca(OH)₂;
CaO + 2HCl = CaCl₂ + H₂O
Ca(OH)₂ + H₂SO₄ = CaSO₄ + 2H₂O
Ca(OH)₂ + 2CO₂ = Ca(HCO₃)₂
Порівняння металічних або неметалічних властивостей із властивостями елементів, що стоять поряд у періоді та групі: Металічні властивості виражені більше, ніж у Берилія й Алюмінію, але менше, ніж у Калія та Стронція
Объяснение: №1. а) Mr(H2SO3)=1*2+32+16*3=2+32+48=82.
б) Mr(Al2S3)=27*2+32*3=54+96=150.
в) Mr(NaNO2)=23+14+16*2=23+14+32=69.
г) Mr(CaF2)=40+19*2=40+38=78.
№2. а) 1) Mr(CaO)=40+16=56.
2) W(Ca)=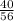 =0,70=70%.
=0,70=70%.
3) W(O)=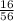 =0,30=30%.
=0,30=30%.
б) 1) Mr(AlCl3)=27+35*3=27+105=132.
2) W(Al)=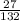 =0,20=20%.
=0,20=20%.
3) W(Cl3)=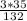 =
=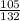 =0,80=80%.
=0,80=80%.
в) 1) Mr(NaCl)=23+35=58.
2) W(Na)=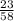 =0,40=40%.
=0,40=40%.
3) W(Cl)=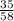 =0,60=60%.
=0,60=60%.
№3. Возьмем 100 грамм этого соединения, тогда масса фосфора 43.66 г, масса кислорода 56.34 г .
Найдем количества вещества:
ню(Р) = 43.66/31 = 1.4 моль .
ню(О) = 56.34/16 = 3.5 моль .
1.4:3.5 разделим на 1.4 будет 1:2.5 умножим на 2 получим 2:5 .
Формула: P2O5 .