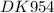Получение кислой соли В пробирку налить 3 - 4 мл раствора гидроксида кальция Cа(ОН)2 (известковой воды) и пропустить через него углекислый газ из аппарата Киппа до растворения первоначально образующегося осадка. Описать наблюдаемые явления. Составить уравнения реакций. Сделать выводы.
Или ответ под цифрой 3, или верного варианта ответа нет.
Объяснение:
N = N(a) * m / M - формула вычисления кол-ва атомов, где N(a) - число Авогадро (6,02 * 10²³ моль⁻¹), m - масса в-ва, M - молярная масса в-ва.
1) 16г O₂
M(O₂) = 16 * 2 = 32 г/моль
N = 6,02*10²³ моль⁻¹ * 16г / 32 г/моль = 3,01 * 10²³ моль⁻¹
2) 30г NO
M(NO) = 14 + 16 = 30 г/моль
N = 6,02*10²³ моль⁻¹ * 30г / 30 г/моль = 6,02 * 10²³ моль⁻¹
3) не дано в-во
4) 8,5 г NH₃
M(NH₃) = 14 + 1 * 3 = 17 г/моль
N = 6,02*10²³ моль⁻¹ * 8,5г / 17 г/моль = 3,01 * 10²³ моль⁻¹
5) 16г SiH₄
M(SiH₄) = 28 + 1 * 4 = 32
N = 6,02*10²³ моль⁻¹ * 16г / 32 г/моль = 3,01 * 10²³ моль⁻¹
6) 11,2 л CO
v = V / V(м) - формула вычисления кол-ва в-ва, где V - объём газа, V(м) - молярный объём газа при н.у.
v(CO) = 11,2 л / 22,4 л/моль = 0,5 (моль)
m = v * M - масса в-ва, где v - кол-во в-ва, М - молярная масса в-ва.
M(CO) = 12 + 16 = 28 г/моль
m = 0,5 моль * 28 г/моль = 14 г
N = 6,02*10²³ моль⁻¹ * 14г / 28 г/моль = 3,01 * 10²³ моль⁻¹
1.
Дано:
m(C₂H₅OH) = 18 гр
m пр(C₂H₅-O-C₂H₅) = 12 гр
Найти:
η(C₂H₅-O-C₂H₅) - ?
1) Для начала мы запишем уравнение реакций для получения диэтилового эфира из этанола, именно по такой уравнений реакций мы будем пользоваться:
2C₂H₅OH (H₂SO₄(конц.), t<140°C) → C₂H₅-O-C₂H₅ + H₂O
2) Для начала мы найдем количества вещества у этанола, а потом у диэтилового эфира по уравнению реакций:
M(C₂H₅OH) = 12×2 + 1×5 + 16 + 1 = 24 + 5 + 17 = 46гр/моль
n(C₂H₅OH) = m(C₂H₅OH)/M(C₂H₅OH) = 18 гр / 46 гр/моль ≈ 0,39 моль ⇒ n(C₂H₅-O-C₂H₅) = 1/2 × n(C₂H₅OH) = 1/2 × 0,39 моль = 0,195 моль - по уравнению реакций
3) Теперь находим теоретическую массу у диэтилового эфира:
M(C₂H₅-O-C₂H₅) = 12×2 + 1×5 + 16 + 12×2 + 1×5 = 24 + 5 + 16 + 24 + 5 = 74 гр/моль
m теор(C₂H₅-O-C₂H₅) = n(C₂H₅-O-C₂H₅) × M(C₂H₅-O-C₂H₅) = 0,195 моль × 74 гр/моль = 14,43 гр
4) Теперь находим выход реакций дегидратаций по такой формуле:
η(C₂H₅-O-C₂H₅) = m пр(C₂H₅-O-C₂H₅) / m теор(C₂H₅-O-C₂H₅) × 100% = 12 гр / 14,43 гр × 100% ≈ 0,832 × 100% ≈ 83,2%
ответ: η(C₂H₅-O-C₂H₅) = 83,2%
2.
Дано:
m(C₆H₅-NO₂) = 13,00 гр
η(C₆H₅-NO₂) = 80%
m пр(C₆H₅-NH₂) = 7,44 гр
Найти:
ω(примесей) - ?
1) Для начала мы запишем уравнение реакций для получения анилина из нитробензола, именно по такой уравнений реакций мы будем пользоваться:
C₆H₅-NO₂ + 3H₂ → C₆H₅-NH₂ + H₂O
2) Для начала мы найдем количества вещества у анилина полученной, а потом у нитробензола по уравнению реакций:
M(C₆H₅-NH₂) = 12×6 + 1×5 + 14 + 1×2 = 72 + 5 + 14 + 2 = 93 гр/моль
n пр(C₆H₅-NH₂) = m пр(C₆H₅-NH₂)/M(C₆H₅-NH₂) = 7,44 гр / 93 гр/моль = 0,08 моль ⇒ n пр(C₆H₅-NO₂) = n пр(C₆H₅-NH₂) = 0,08 моль
3) Теперь находим количества вещества у нитробензола в теоретической части:
η(C₆H₅-NO₂) = n пр(C₆H₅-NO₂) / n теор(C₆H₅-NO₂) × 100% ⇒ n теор(C₆H₅-NO₂) = (n пр(C₆H₅-NO₂)×100%)/η(C₆H₅-NO₂) = (0,08 моль × 100%)/80% = 0,08 моль × 1,25 = 0,1 моль
4) Теперь находим теоретическую массу у нитробензола:
M(C₆H₅-NO₂) = 12×6 + 1×5 + 14 + 16×2 = 72 + 5 + 14 + 32 = 123 гр/моль
m теор(C₆H₅-NO₂) = n теор(C₆H₅-NO₂) × M(C₆H₅-NO₂) = 0,1 моль × 123 гр/моль = 12,3 гр
5) Теперь находим массу примесей в исходном образце нитробензола:
m(примесей) = m(C₆H₅-NO₂) - m теор(C₆H₅-NO₂) = 13,00 гр - 12,3 гр = 0,7 гр
6) Теперь находим массовую долю примесей в исходном образце нитробензола:
ω(примесей) = m(примесей)/m(C₆H₅-NO₂) × 100% = 0,7 гр / 13,00 гр × 100% ≈ 0,054 × 100% ≈ 5,4%
ответ: ω(примесей) = 5,4%
Решено от :