При нагревании 7,5 мл предельного одноатомного спирта (плотностью 0,8 г/мл), в присутствии концентрированной серной кислоты,выделилось 2,24 л газообразного непредельного углеводорода (н.у). молекулярная формула спирта ()
4) Теперь находим молекулярную массу неизвестного металла, полученный результат смотрим в таблицу Менделеева и мы смотрим какое вещество подходит к полученной из нашего результата:
Алюминий (лат. Аluminium, химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815) — мягкий, легкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C. По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. В природе представлен лишь одним стабильным нуклидом 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26Al имеет период полураспада 720 тысяч лет.
Алюминий - наиболее распространенный металл на земле, а по распространенности всех элементов в земной коре он занимает третье место. На его долю приходится 8% состава земной коры. Бокситная руда в настоящее время является главным сырьем для получения алюминия. Ежегодно в мире добывают от 80 до 90 млн. тонн бокситной руды. Почти 30% этого колличества добывают в Австралии и еще 15% на Ямайка. При нынешнем уровне мирового производства алюминия разведанных на земле запасов бокситов достаточно, чтобы обеспечивать потребности в алюминии еще несколько сотен лет.
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов, автомобилей. В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности - для изготовления оконных рам и дверей, а в пищевой промышленности - для изготовления упаковочных материалов. В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
атинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Дано:
m(MeO) = 4,975 гр
m(Me) = 3,91 гр
Найти:
MeO - ?
V(H₂) - ?
1) Для начала запишем уравнение реакций неизвестного металла, именно по такой уравнений реакций мы будем пользоваться:
MeO + H₂ → Me + H₂O
2) Далее находим массу кислорода находящийся в оксиде металла:
m(O) = m(MeO) - m(Me) = 4,975 гр - 3,91 гр = 1,065 гр
3) Теперь находим количества вещества кислороде, а потом у неизвестного металла по уравнению реакций:
M(O) = 16 гр/моль
n(O) = m(O)/M(O) = 1,065 гр / 16 гр/моль = 0,0665625 моль ≈ 0,067 моль ≈ 0,07 моль ⇒ n(Me) = n(O) = 0,07 моль
4) Теперь находим молекулярную массу неизвестного металла, полученный результат смотрим в таблицу Менделеева и мы смотрим какое вещество подходит к полученной из нашего результата:
M(Me) = m(Me)/n(Me) = 3,91 гр / 0,07 моль ≈ 55,86 гр/моль ≈ 56 гр ⇒ Fe - железо
5) Теперь известный металл записываем в уравнение реакций:
FeO + H₂ → Fe + H₂O
6) Теперь находим количества вещества оксида железа (II), а потом у воды по уравнению реакций:
M(FeO) = 56 + 16 гр/моль = 72 гр/моль
n(FeO) = m(MeO)/M(FeO) = 4,975 гр / 72 гр/моль ≈ 0,069 моль ⇒ n(H₂) = n(FeO) = 0,069 моль - по уравнению реакций
7) Теперь находим объем водорода:
Vm = 22,4 л/моль
V(H₂) = n(H₂) × Vm = 0,069 моль × 22,4 л/моль = 1,5456 л ≈ 1,55 л
ответ: V(H₂) = 1,55 л
Решено от :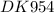
Алюминий (лат. Аluminium, химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815) — мягкий, легкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C. По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. В природе представлен лишь одним стабильным нуклидом 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26Al имеет период полураспада 720 тысяч лет.
Алюминий - наиболее распространенный металл на земле, а по распространенности всех элементов в земной коре он занимает третье место. На его долю приходится 8% состава земной коры. Бокситная руда в настоящее время является главным сырьем для получения алюминия. Ежегодно в мире добывают от 80 до 90 млн. тонн бокситной руды. Почти 30% этого колличества добывают в Австралии и еще 15% на Ямайка. При нынешнем уровне мирового производства алюминия разведанных на земле запасов бокситов достаточно, чтобы обеспечивать потребности в алюминии еще несколько сотен лет.
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов, автомобилей. В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности - для изготовления оконных рам и дверей, а в пищевой промышленности - для изготовления упаковочных материалов. В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
атинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12H2O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.
Только через четверть века этот удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.
Промышленный производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.
Объяснение: