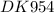При восстановлении водородом 4,975гоксида металла (2) было получено 3.91г металла. Какой оксид участвовал в реакции? Какой объем водорода (н.у.) был израсходован?
4) Теперь находим молекулярную массу неизвестного металла, полученный результат смотрим в таблицу Менделеева и мы смотрим какое вещество подходит к полученной из нашего результата:
Дано:
m(MeO) = 4,975 гр
m(Me) = 3,91 гр
Найти:
MeO - ?
V(H₂) - ?
1) Для начала запишем уравнение реакций неизвестного металла, именно по такой уравнений реакций мы будем пользоваться:
MeO + H₂ → Me + H₂O
2) Далее находим массу кислорода находящийся в оксиде металла:
m(O) = m(MeO) - m(Me) = 4,975 гр - 3,91 гр = 1,065 гр
3) Теперь находим количества вещества кислороде, а потом у неизвестного металла по уравнению реакций:
M(O) = 16 гр/моль
n(O) = m(O)/M(O) = 1,065 гр / 16 гр/моль = 0,0665625 моль ≈ 0,067 моль ≈ 0,07 моль ⇒ n(Me) = n(O) = 0,07 моль
4) Теперь находим молекулярную массу неизвестного металла, полученный результат смотрим в таблицу Менделеева и мы смотрим какое вещество подходит к полученной из нашего результата:
M(Me) = m(Me)/n(Me) = 3,91 гр / 0,07 моль ≈ 55,86 гр/моль ≈ 56 гр ⇒ Fe - железо
5) Теперь известный металл записываем в уравнение реакций:
FeO + H₂ → Fe + H₂O
6) Теперь находим количества вещества оксида железа (II), а потом у воды по уравнению реакций:
M(FeO) = 56 + 16 гр/моль = 72 гр/моль
n(FeO) = m(MeO)/M(FeO) = 4,975 гр / 72 гр/моль ≈ 0,069 моль ⇒ n(H₂) = n(FeO) = 0,069 моль - по уравнению реакций
7) Теперь находим объем водорода:
Vm = 22,4 л/моль
V(H₂) = n(H₂) × Vm = 0,069 моль × 22,4 л/моль = 1,5456 л ≈ 1,55 л
ответ: V(H₂) = 1,55 л
Решено от :