H₂SO₄ + Zn = ZnSO₄ + H₂
1) Найдем массу раствора серной кислоты:
⇒ m=p×V
m(р-ра)= 1,14×100=114 г
2) Найдем массу чистой (безводной) кислоты:
ω=m(в-ва)÷m(р-ра)×100% ⇒ m(в-ва)=ω×m(р-ра)÷100%
m(H₂SO₄)==22,8 г
3) Через расчет по уравнению реакции найдем массу сульфата цинка:
M(H₂SO₄)= 98 г/моль
M(ZnSO₄)= 161 г/моль
m(H₂SO₄)= 22,8 г
m(ZnSO₄)= х г
98 г H₂SO₄ дают 161 г ZnSO₄
22,8 г H₂SO₄ дают х г ZnSO₄
37,5 г ZnSO₄
ответ: масса сульфата цинка 37,5 г.
Zn+2H2SO4=ZnSO4+SO2+2H2O
1)m (р-ра H2SO4)=V*p=100*1.14=114
m(в-ва H2SO4)=114*20/100=22.8
2)M(H2SO4)=2+32+16*4=98
98*2=196(т.к. перед H2SO4 коэффиэциент 2 в формуле)
M(ZnSO4)=65+32+16*4=161
3) m(в-ва ZnSO4)= 22.8*161/196=18.728(ответ)
вроде так
H₂SO₄ + Zn = ZnSO₄ + H₂
1) Найдем массу раствора серной кислоты:
m(р-ра)= 1,14×100=114 г
2) Найдем массу чистой (безводной) кислоты:
ω=m(в-ва)÷m(р-ра)×100% ⇒ m(в-ва)=ω×m(р-ра)÷100%
m(H₂SO₄)=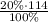 =22,8 г
=22,8 г
3) Через расчет по уравнению реакции найдем массу сульфата цинка:
M(H₂SO₄)= 98 г/моль
M(ZnSO₄)= 161 г/моль
m(H₂SO₄)= 22,8 г
m(ZnSO₄)= х г
98 г H₂SO₄ дают 161 г ZnSO₄
22,8 г H₂SO₄ дают х г ZnSO₄
ответ: масса сульфата цинка 37,5 г.
Zn+2H2SO4=ZnSO4+SO2+2H2O
1)m (р-ра H2SO4)=V*p=100*1.14=114
m(в-ва H2SO4)=114*20/100=22.8
2)M(H2SO4)=2+32+16*4=98
98*2=196(т.к. перед H2SO4 коэффиэциент 2 в формуле)
M(ZnSO4)=65+32+16*4=161
3) m(в-ва ZnSO4)= 22.8*161/196=18.728(ответ)
вроде так