Рассчитать растворимость сульфида серебра (ag2s) в г/л, пр =7.2*10^-50. как изменится концентрация сульфид ионов в растворе, если в него добавить agno3 до концентрации 1моль/л (α=1)?
Концентрация ионов серебра определяется теперь не только количеством продиссоциировавших молекул сульфида серебра, но и концентрацией продиссоциировавших молекул нитрата серебра.
Нитрат серебра - сильный электролит, поэтому диссоциирует полностью.
Приближённо можем считать концентрацию ионов серебра равной концентрации добавленной в раствор соли. Это сильно упрощает расчёт и позволяет вычислить концентрацию сульфид-ионов:
Уравнение диссоциации только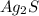 :
:
Произведение растворимости:
Отсюда находим молярную растворимость:
Растворимость, выраженная в граммах на литр:
Ионный баланс раствора, содержащего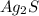 и
и 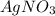 :
:
Концентрация ионов серебра определяется теперь не только количеством продиссоциировавших молекул сульфида серебра, но и концентрацией продиссоциировавших молекул нитрата серебра.
Нитрат серебра - сильный электролит, поэтому диссоциирует полностью.
Приближённо можем считать концентрацию ионов серебра равной концентрации добавленной в раствор соли. Это сильно упрощает расчёт и позволяет вычислить концентрацию сульфид-ионов: