с Химией Общая формула ацетиленовых углеводородов (алкинов):
а) СnH2n б) CnH2n+2
в) CnH2n-2 г) CnHn
2. Тип реакций, характерных для алкенов:
а) замещения б) разложения
в) обмена г) присоединения
3. В органических соединениях углерод проявляет валентность, равную:
а) 1 б) 2
в) 3 г) 4
4. Получение бутадинета-1,3 из этилового спирта это метод:
а) Кучерова б) Зелинского
в) Бутлерова г) Лебедева
5. Гомологи имеют общую формулу и отличаются друг от друга:
а) химическими свойствами б) химической активностью
в) на группу СН2 г) химическим строением
6. Сумма коэффициентов в реакции горения этилена равна (написать уравнение реакции):
а) 6 б) 12
в) 8 г) 10
7. В молекуле алкадиенов связи:
а б) одна двойная связь
в) две двойные связи г) тройные
8. Какой объем кислорода (н.у.) требуется для сгорания 64 г метилового спирта (привести решение):
а) 22,4 б) 33,6
в) 44,8 г) 67,2
9. Как называется процесс высокотемпературного нагревания угля без доступа воздуха?
а) крекингом б) риформингом
в) ректификацией г) коксованием
10. Пример алкадиена с кумулированными двойными связями:
а) пропадиен б) пентадиен – 1,4
в) бутадиен – 1,3 г) бутадиен – 1,2
11. Вещество, структурная формула которого
СН3 – СН2 – С = СН – СН2 – С = СН – СН3
СН3 СН3
а) 3,6 – диметилоктадиен – 3,6 б) 3,6 – диметилоктадиен – 2,5
в) 3,6 – диметилоктен – 3,6 г) 3,6 – диметилоктен – 2,5
12. В молекуле бензола все связи:
а) одинарные б) двойные
в) одинарные и двойные г) равноценные
13. Молярная масса этилбензола , г/моль (привести решение):
а) 92 б) 78
в) 106 г) 86
14. Реакция отщепления водорода – это реакция:
а) гидратации б) дегидратации
в) гидрирования г) дегидрирования
15. Мономером в реакциях полимеризации для получения синтетического каучука является:
а) изопрен б) дивинил
в) пентадиен – 1,3 г) бутадиен – 1,2
16. Общая формула ароматических углеводородов (аренов):
а) СnH2n б) CnH2n+2
в) CnH2n-6 г) CnHn
17. Изомером для бутина – 1 будет?
а) 2 – метилпропан б) бутин – 2
в) этин г) пентин-1
18. В каком ряду органических соединений находятся только алканы:
а) С2Н6, С3Н8, С4Н10 б) С2Н2, С4Н8, С6Н6
в) С10Н20, С8Н16, С3Н6 г) СН4, С2Н4, С4Н6
19. Укажите реакцию замещения:
а) СН4 + Cl2 → б) СН2=СН2 + Br2 →
H2SO4(к);150°С
в) СН3-СН2ОН → г) CH3-NH2 + HCl →
20. Название углеводорода, смеющего формулу С6Н12:
а) пентен б) гексен
в) гептен г) октен
II I
MgCl₂
Объяснение:
т.к. Mg стоит во второй группе хим. элементов его валентность будет равна II (валентность обозначается римскими цыфрами), а Cl стоит в седьмой группе - его валентность мы определяем следующим образом: 8 (кол-во групп) - 7 (та группа, в которой стоит сам хлор) = 1 валентность хлора
дальше расставляем полученные значения над элементами и просто используем "правило крест-накрест", т.е. валентность Mg будет обозначать кол-во атомов хлора (цифра, что расположена внизу) в данном хим. соединении, а валентность хлора - кол-во атомов Mg
Примечание: подобное правило работает не во свех хим. формулах
1. Докажите опытным путём состав: а) гидроксида кальция; б) сульфата аммония.
а) Проведём качественную реакцию на гидроксид-ион. Для этого воспользуемся индикаторами. Гидроксид кальция - основание малорастворимое, но тем не менее некоторое количество растворяется, следовательно среду изменять будет. Возьмём индикатор фенолфталеин, добавим его в пробирку с гидроксидом кальция, в результате раствор частично изменит цвет на малиновый - следовательно среда щелочная (слабощелочная).
б) Проведём качественную реакцию на сульфат-ион. Для этого возьмём любую растворимую соль бария (по стандарту - хлорид бария), добавим его в раствор с сульфатом аммония. В ходе реакции выпадает белый осадок - сульфат бария. Реакция выглядит следующим образом:
ᅠᅠ
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой, и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза:
1. Нитрат натрия - соль, образованная сильным основанием NaOH и сильной кислотой HNO₃, гидролиз протекать не будет, среда нейтральная. Это можно доказать следующим путём: возьмём индикатор метиловый оранжевый, добавим его в раствор нитрата натрия, в результате цвет изменится на оранжевый. Это и есть признак нейтральной среды.
2. Карбонат натрия - соль, образованная сильным основанием NaOH и слабой кислотой H₂CO₃. Гидролиз протекает по аниону, образующаяся среда - щелочная, гидролиз обратимый, протекает в две стадии:
ᅠᅠ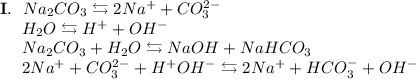
ᅠᅠ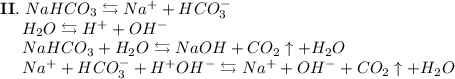
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на жёлтый, следовательно реакция среды щелочная.
3. Нитрат цинка - соль, образованная слабым основанием Zn(OH)₂ и сильной кислотой HNO₃. Гидролиз протекает по катиону, образующаяся среда - кислая, гидролиз обратимый, протекает в две стадии:
ᅠᅠ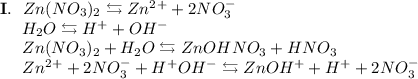
ᅠᅠ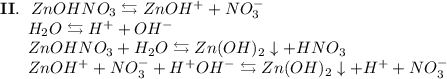
Добавим в раствор метиловый оранжевый. Раствор поменяет цвет на красный, следовательно реакция среды кислая.
3. Практически осуществите все следующие превращения: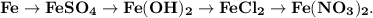
1. Получим сульфат железа путём реакции железа и разбавленной серной кислоты:
ᅠᅠ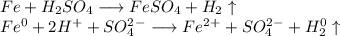
С точки зрения ОВР:
ᅠᅠ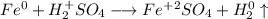
ᅠᅠ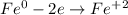 | 2 | 1 | окисление
| 2 | 1 | окисление
ᅠᅠ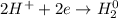 | 2 | 1 | восстановление
| 2 | 1 | восстановление
ᅠᅠFe - восстановитель, H₂SO₄ (2H⁺) - окислитель.
2. Получим гидроксид железа путём реакции сульфата железа и гидроксида калия:
ᅠᅠ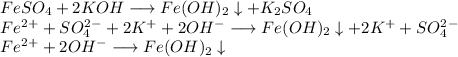
3. Получим хлорид железа путём реакции гидроксида железа и хлороводородной кислоты:
ᅠᅠ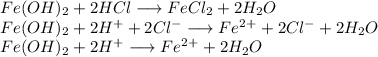
4. Получим нитрат железа путём реакции хлорида железа и азотной кислоты: