с химией за Задача 1. При сгорании 0,2 г органического вещества образовалось 313,6 мл (н.у.) углекислого газа и 0,288 г воды. Известно, что данное вещество не содержит вторичных атомов углерода и реагирует с хлором на
свету. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества с хлором на свету. Задача 2. Органическое вещество содержит 51,89% углерода, 9,73% водорода и 38,38% хлора. Известно, что данное вещество вступает в реакцию Вюрца с образованием 2,5-диметилгексана. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции Вюрца с участием данного вещества. Задача 3. При сгорании смеси метана и бутана образовалось 47,04 л (н.у.) углекислого газа и 54 г воды. Определите массовые доли компонентов в исходной смеси.
Задача 4. При полном сгорании 21,6 г смеси этана и пропана получили 32,48 л (н.у.) углекислого газа. Вычислите массовые доли компонентов в исходной
смеси.
Задача 5. При сгорании смеси метана и этана образовалось 20,16 л (н.у.) углекислого газа и 27,9 г воды. Определите массовые доли компонентов в исходной смеси. Задача 6. При полном сгорании 19 г смеси пропана и бутана получили 29,12 л (н.у.) углекислого газа. Вычислите массовые доли компонентов в исходной
смеси.
Відповідь:
а) Na2SO4 + BaCl2 ⇒ 2NaCl + BaSO4↓;
б) Na2CO3 + 2HCl ⇒ NaCl + CO2↑ + H2O;
в) отсутствует.
Пояснення:
Для того чтобы решить это задание нужно написать формулы всех веществ и посмотреть с каких ионов они состоят:
сульфата натрия - Na2SO4 (Na+ и SO4 2-)
хлорида бария - BaCl2 (Ba2+ и 2Cl-) и т.д.
карбоната натрия - Na2CO3
сульфата меди (II) - CuSO4
сульфида натрия - Na2S
хлорида алюминия - AlCl3
хлорида натрия - NaCl
хлорида железа (III) - FeCl3
гидроксида натрия - NaOH
соляной кислоты - HCl.
Потом нужно открыть таблицу «Растворимость кислот, оснований и солей в воде» и посмотреть к чему приведет взаимодействие (по реакции обмена) каждого вещества с каждым. Но при этом сразу исключи взаимодействие веществ с одинаковыми ионами или анионами. У тебя же не будет взаимодействовать например Na2S + NaCl, или BaCl2 + NaCl. Все остальные реакции перемотри в таблице и выпиши на листок. Потом продукты проверь в таблице: если на пересечении аниона и иона будет "р" - вещество растворимое, если "м" - малодиссоциирующее, если "н" - нерастворимое, если прочерк - соединение не существует, реакция не идет.
Я напишу по одному примеру к а), б) и в). Остальное попробуй найти сам/сама чтобы усвоить что надо делать.
а) осадок (нерастворимое вещество):
например Na2SO4 + BaCl2 ⇒ 2NaCl + BaSO4↓ (выпал в осадок, буква "н" в таблице). Также в таблице есть цвета - в ячейке этого вещества - цвет желтый и это означает что среда нейтральная (цвет ячейки может менятся в зависимости от таблицы в учебнике/интеренете). Но как мы можем определить среду экспериментально? Есть индикаторы: фенолфталеин, метилоранж, лакмус. Открываем таблицу индикаторов. Видим что в нейтральной среде, например при добавлении лакмуса - цвет расствора стает фиолетовый. Или при добавлении метил оранжа - оранжевый. Так и доказываем что среда нейтральная.
б) газ:
Тут немного посложнее, надо знать дополнительно в каких случаях образовывается газ. Самый класический - это если в результате взаимодействия двух веществ получается угольная кислота, которая не стойкая и всегда разлагается на углекислый газ (CO2) и воду (H2O).
Ищем в результате взаимодействия какиих веществ может образоваться угольная кислота (H2CO3), это:
Na2CO3 + 2HCl ⇒ 2NaCl + H2CO3 ⇒ NaCl + CO2↑ + H2O. Пока СО2 еще не полностью выделился среда расствора будет кислой, в экспериментальных условиях кислая среда проверяеся метилоржанжевым индикатором, который изменяет окрас с оранжевого на розовый.
в) малодиссоциирующее вещество (за тем же принципом что и вариант а, даже немного легче, т.к. буквы "м" в ячейках можно пересчитать на пальцах).
Если ты в условии все правильно написал/(а) по названиям то у тебя нет в веществах ионов и анионов прореагировать с образованием малодиссоциирующего вещества.
Но если ты невнимательно написал/(а) условие и там где-то сульфит, а не сульфат, то ответ будет.
Объяснение:
ТеорияЧисло молекул в количестве вещества связывает число Авогадро - число молекул вещества в его одном моле
Число Авогадро обозначается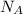 и оно равно
и оно равно 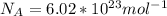
Количество вещества (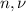 , допустимы обе записи) это отношение числа молекул (
, допустимы обе записи) это отношение числа молекул (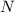 ) к числу молекул одного моля, числу Авогадро (
) к числу молекул одного моля, числу Авогадро (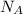 ):
):
Следовательно, чтобы найти число молекул нужно количество вещества умножить на число Авогадро:
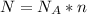
РешениеВыполним для нашей задачи, нам известно количество вещества уксусной кислоты, оно равно 0,1 моль (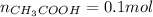 ) найдем число молекул
) найдем число молекул 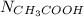 :
:
В десятой моль кислоты содержится столько молекул
ФормулыДругие формулы связывающие количество вещества и другие параметры: