с тестом по химии за 9 класс
Тест «Щелочные металлы»
1. В ряду химических элементов Li – Na – K – Rb – Cs металлические свойства:
а) усиливаются б) ослабевают
в) изменяются периодически г) не изменяются
2. Найдите формулу оксида и гидроксида элемента, электронная формула внешнего энергетического уровня которого …3s1
а) RO и R(OH)2 б) RO и RH
в) R2O и ROH г) R2O7 и HRO4
3. Наибольший радиус имеет атом элемента:
а) Li б) K в) Na г) Rb
4. Определите свойства, характерные для щелочных металлов
а) наиболее сильные восстановители, степень окисления в соединениях +1
б) проявляют окислительные свойства
в) очень мягкие, легко режутся ножом
г) в природе встречаются в свободном виде
5. Реакция натрия с водой
а) замещение, эндотермическая
б) соединение, экзотермическая
в) замещение, экзотермическая
г) разложение, экзотермическая.
6. Расположите вещества по увеличению основных свойств:
а) LiOH б) KOH в) NaOH г) RbOH
7. С раствором щелочи взаимодействуют все вещества группы:
а) HCl, Cu(OH)2 , CuO, BaCl2
б) H2SO4, Zn(OH)2, Al2O3, CuSO4
в) H2S, Mg(OH)2, MgO, CO2
г) HNO3, Fe(OH)2, FeO, SrCl2
8. Соли натрия окрашивают пламя в …цвет
а) голубой б) красный в) фиолетовый г) желтый
9. В производстве стекла, бумаги, мыла применяется каустическая сода, формула которой:
а) Na2CO3 б) Na2CO3 ∙ 10 H2O
в) NaOH г) Na2SO4 ∙ 10 H2O
10. Ряд формул соответствующих хлориду, сульфиду, гидриду натрия, - это:
а) NaH, Na2S, Na2O;
б) NaCl, NaBr, NaOH;
в) NaCl, Na2S, NaH.
г) Na2O, NaOH, Na2S
1) В пределах одной группы металлические свойства возрастают при увеличении порядкового номера элемента. Это связано с увеличением радиуса атома и более легким отхождением электронов от ядра.
ОТВЕТ: а)
2) Имея только один электрон на внешнем энергетическом уровне, элемент может иметь валентность только 1, соответственно может содержать только одну ОН группу и два атома на кислород в окисде.
ОТВЕТ: в)
3) Как уже было сказано в первом номере, в одной группе радиус атома увеличивается с увеличением его порядкового номера.
ОТВЕТ: г)
4) Щелочные металлы невероятно активны, и всячески стремятся перейти в устойчивую для себя форму иона, с зарядом +1. Поэтому в свободной форме в природе не встречаются и окислительных свойств не проявляют почти совсем, а восстановительных в степени окисления +1 в принципе не могут проявлять, но что правда про них, это то, что их действительно почти все можно спокойно резать ножом и намазывать на хлеб, главное потом не есть)
ОТВЕТ: в)
5) Реакция натрия с водой невероятно экзотермична. Натрий как бешеный носится по поверхности и искрит. В то же время это является реакцией замещения водорода на натрий. Продуктом реакции является щелочь.
ОТВЕТ: в)
6) Основные свойства щелочей тем выше, чем активнее металл, входящий в соединение наиболее активным металлом является литий.
ОТВЕТ: а)
7) С раствором щелочи точно не могут взаимодействовать основные соединения. Могут лишь кислотные и амфотерные. Могут таже растворимые соли, если в результате реакции получается нерастворимвый гидроксид.
ОТВЕТ: б)
8) Соли натрия содержает его ионы. Ионы натрия окрашивают пламя горелки в желтый цвет.
ОТВЕТ: г)
9) Каустическая сода (она же едкий натр) - тривиальное название гидроксида натрия
ОТВЕТ: в)
10) Хлорид соединие вида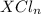 , сульфид
, сульфид 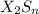 , гидрид
, гидрид 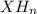 .
.
ОТВЕТ: в)