Смесь бромида и хлорида натрия с примесью нитрата натрия (масса
смеси равна 10,00 г) растворили в воде. К полученному раствору
прибавили раствор, содержащий 30,60 г нитрата серебра(I). Выпавший
осадок отфильтровали, высушили и взвесили. Масса осадка оказалась
равной 20,98 г. При добавлении к фильтрату избытка раствора хлорида
калия образовалось еще 5,74 г осадка.
1.Запишите уравнения реакций, протекавших в описанном эксперименте, в
молекулярной форме
2. Рассчитайте массы (г) бромида натрия и хлорида натрия в исходной смеси солей
O O
// //
CH3 -C + Ag2O = CH3 - C + 2Ag
\ \
H OH
Вычисляем количество вещества оксида серебра
n(Ag) = m/M = 0,54 г/ 108/моль = 0,005 моль
По уравнению реакции n(CH3COH) = n(Ag) = 0,005 моль
Находим массу альдегида
m(CH3COH) = n x M = 0,005 моль х 44г/моль = 0,22 г
Предложенное сокращённое ионное уравнение -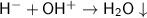 .
.
Ошибка №1. Заряд иона водорода должен быть равен 1+, а не 1-. То есть вместо H⁻ должно быть Н⁺ (именно катион водорода с гидроксид-ионом образует молекулу воды).
Ошибка №2. Заряд гидроксид-иона должен быть равен 1-, а не 1+. То есть вместо ОН⁺ должно быть ОН⁻ (степень окисления кислорода равна -2, а степень окисления водорода равна +1 ⇒ тогда общий заряд гидроксид-иона равен : -2 + 1 = 1-).
Ошибка №3. После молекулы воды стрелку вниз ( ) ставить не нужно, так как вода является слабым электролитом, но не осадком.
) ставить не нужно, так как вода является слабым электролитом, но не осадком.
Верное сокращённое ионное уравнение - .
.
ответ : 3.