1. H2SO4 + Na2O = Na2SO4 + H2O
(серная (оксид (сульфат
кислота) натрия) натрия)
1) n(H2SO4)=m(H2SO4)/M(H2SO4)
n-количество вещества, m- масса, M- молекулярная масса
n(H2SO4)= 19,6 г/ (1*2+32+16*4)г/моль= 0,2 моль
(М считается следующим образом: масса атома, которая написана в таблице Менделеева ( у Н=1,S=32, О=16), умножается на его количество в в веществе)
n(H2SO4)= n(Na2SO4)= 0,2 моль (т.к. они в одинаковом соотношении 1:1)
2) m(Na2SO4)= n(Na2SO4)*M(Na2SO4)
m(Na2SO4)= 0,2 моль* (23*2+32+16*4)=28,4 г
2. 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
(гидроксид (сульфат (гидроксид
натрия) меди) меди)
1) n(Cu(OH)2)=m(Cu(OH)2)/M(Cu(OH)2)
n(Cu(OH)2)= 16 г/ (64+16*2+1*2)г/моль= 0,16 моль
n(NaOH)= 0,32моль (т.к. NaOH взят в 2 раза больше, чем Cu(OH)2)
m(NaOH)= n(NaOH)*M(NaOH)
m(NaOH)= 0,32моль*(23+16+1)г/моль= 12,8 г
Может, ортофосфата кальция? А хотя без разницы! Значит, в 50 кг костей содержится 58% ортофосфата кальция.
Дано:
m(костей)=50кг
W()=58%
Найти:
m(P)- ?
1) Найдём сколько кг ортофосфата кальция содержится в костях:
50кг-100%
xкг-58% => xкг=50кг * 58% / 100%= 29, следовательно, 29 кг ортофосфата кальция содержится в костях.
2) W(P) в ортофосфате кальция () = M(P)/
M()=31*2 / 310,18 г/моль / 100%=20%
3) Рассчитаем, сколько кг фосфора содержится в ортофосфате кальция:
29кг-100%
xкг-20% => xкг=29кг * 20% / 100%=5,8кг.
Всё! Думаю, что 5,8 кг фосфора содержится в 50 кг костей!
ответ: m(P)=5,8кг.
1. H2SO4 + Na2O = Na2SO4 + H2O
(серная (оксид (сульфат
кислота) натрия) натрия)
1) n(H2SO4)=m(H2SO4)/M(H2SO4)
n-количество вещества, m- масса, M- молекулярная масса
n(H2SO4)= 19,6 г/ (1*2+32+16*4)г/моль= 0,2 моль
(М считается следующим образом: масса атома, которая написана в таблице Менделеева ( у Н=1,S=32, О=16), умножается на его количество в в веществе)
n(H2SO4)= n(Na2SO4)= 0,2 моль (т.к. они в одинаковом соотношении 1:1)
2) m(Na2SO4)= n(Na2SO4)*M(Na2SO4)
m(Na2SO4)= 0,2 моль* (23*2+32+16*4)=28,4 г
2. 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
(гидроксид (сульфат (гидроксид
натрия) меди) меди)
1) n(Cu(OH)2)=m(Cu(OH)2)/M(Cu(OH)2)
n(Cu(OH)2)= 16 г/ (64+16*2+1*2)г/моль= 0,16 моль
n(NaOH)= 0,32моль (т.к. NaOH взят в 2 раза больше, чем Cu(OH)2)
m(NaOH)= n(NaOH)*M(NaOH)
m(NaOH)= 0,32моль*(23+16+1)г/моль= 12,8 г
Может, ортофосфата кальция? А хотя без разницы! Значит, в 50 кг костей содержится 58% ортофосфата кальция.
Дано:
m(костей)=50кг
W(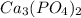 )=58%
)=58%
Найти:
m(P)- ?
1) Найдём сколько кг ортофосфата кальция содержится в костях:
50кг-100%
xкг-58% => xкг=50кг * 58% / 100%= 29, следовательно, 29 кг ортофосфата кальция содержится в костях.
2) W(P) в ортофосфате кальция (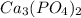 ) = M(P)/
) = M(P)/
M(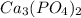 )=31*2 / 310,18 г/моль / 100%=20%
)=31*2 / 310,18 г/моль / 100%=20%
3) Рассчитаем, сколько кг фосфора содержится в ортофосфате кальция:
29кг-100%
xкг-20% => xкг=29кг * 20% / 100%=5,8кг.
Всё! Думаю, что 5,8 кг фосфора содержится в 50 кг костей!
ответ: m(P)=5,8кг.