Составьте энергетические диаграммы распределения электронов по молекулярным орбиталям реальных или гипотетических частиц, формулы которых указаны в таблице, оцените прочность этих частиц. частицы o2,h2
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
- уравнение Нернста
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
Судя по уравнению реакции из одного моль CaCO₃ получается по одному моль CaO и CO₂. Пропорция 1 к 1, то есть из 5 моль карбоната кальция получается по 5 моль каждого продукта. Тогда массы продуктов реакции будут равняться:
m (CaO) = n × Mr (CaO) = 5 × 56 = 280 грам
m (CO₂) = n × Mr (CO₂) = 5 × 44 = 220 грам
2) Опять таки сначала реакция:
6Li + N₂ = 2Li₃N
По уравнению реакции видно что из 6 моль лития и 1 моль азота получается 2 моля литий нитрида.
Составим пропорцию, по которой найдем количество моль лития:
Дано:
T = 293 К
[Ca²⁺] = 70 моль/л
Найти:
E(Ca²⁺/Ca) - ?
Для нахождения активности ионов металла в растворе единице для определения величины электродного потенциала используется уравнение Нернста, именно по такой формуле мы найдем потенциал кальциевого электрода:
E°(Ca²⁺/Ca) = -2,87 В - из табличного значения про "Стандартные электродные потенциалы"
F = 96500 Кл/моль - Число Фарадея
R = 8,31 Дж/(моль×К) - Универсальная газовая постоянная
n = 2 - Валентность иона кальция
E(Ca²⁺/Ca) = -2,87 В + (8,31 Дж/(моль×К) × 293 К) / (2 × 96500 Кл/моль) × lg 70 = -2,87 В + (2434,83 Дж/моль) / (193000 Кл/моль) × lg(10×7) ≈ -2,87 В + 0,0126 Дж/Кл × (lg 10 + lg 7) ≈ -2,87 В + 0,0126 В × (1 + 0,845) ≈ -2,87 В + 0,0126 В × 1,845 ≈ - 2,87 В + 0,0233 В ≈ -2,8467 В ≈ -2,85 В
ответ: E(Ca²⁺/Ca) = -2,85 В
Решено от :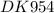
№ 1
m (CaO) = 280 грам
m (CO₂) = 220 грам
№ 2m (Li) = 15.75 грам
V (N₂) = 8.4 литра
Объяснение:
1) Для начала - уравнение реакции:
CaCO₃ = CaO + CO₂
Судя по уравнению реакции из одного моль CaCO₃ получается по одному моль CaO и CO₂. Пропорция 1 к 1, то есть из 5 моль карбоната кальция получается по 5 моль каждого продукта. Тогда массы продуктов реакции будут равняться:
m (CaO) = n × Mr (CaO) = 5 × 56 = 280 грам
m (CO₂) = n × Mr (CO₂) = 5 × 44 = 220 грам
2) Опять таки сначала реакция:
6Li + N₂ = 2Li₃N
По уравнению реакции видно что из 6 моль лития и 1 моль азота получается 2 моля литий нитрида.
Составим пропорцию, по которой найдем количество моль лития:
6 моль = 2 моль
Х моль = 0.75 моль
Отсюда:
Х = 6 × 0.75 ÷ 2 = 2.25 моль
Теперь так же найдем количество вещества азота:
1 моль = 2 моль
Х моль = 0.75
Отсюда:
Х = 0.75 ÷ 2 = 0.375 моль
Теперь можно находить массу лития:
m (Li) = n × Mr (Li) = 2.25 × 7 = 15.75 грам
И объем азота:
V (N₂) = n × Vm = 0.375 × 22.4 = 8.4 литра