Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.) , в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С) , получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т.
оксид серы (VI)
кислотный оксид
Степень окисления кислорода, как в любом оксиде, равна -2.
Степень окисления серы равна +6;
нитрат меди (II)
соль, имеет кисоую реакцию, так как гидролизуется по катиону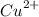 , как соль, образованная слабым основанием
, как соль, образованная слабым основанием 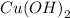 и сильной кислотой
и сильной кислотой 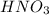 .
.
Cтепень окисления меди равна +2, степень окисления азота равна +5, степень окисления кислорода равна -2.
хлорат калия
нейтральная соль, поскольку образована сильными электролитами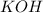 и
и 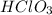
Степени окисления:
калий +1
хлор +5
кислород -2
фосфористая кислота, слабая
Степени окисления:
водород +1
фосфор +3
кислород -2