Вариант 5.
1). рассчитайте теплоту сгорания и теплотворную этилена с2н4 (энтальпия
образования этилена равна +52 кдж/моль). сколько тепла выделяется при горении 14 гэтилена?
какой объем со, образуется при этом?
2). возможно ли самопроизвольное протекание при стандартных условиях реакции:
2h2o2(ж) =2h2o(ж) + o2(г)
s° 298,
вещество | состояние | дн°298,
кдж/моль дж/моль•к
н,0,
ж
81
76
н,0 | ж
-286
70
о,
газ
205
3). оцените изменение энтропии (> 0, < 0 или = 0) в реакциях:
2сн2 (0) + 50, (0) = 4co2(0) + 2h,0 г),
2h2so4(p-p) + cu(тв) = cuso4(p-p) + 2h2o(ж) + so2(г),
hso4(p-p) + 2naoh(p-p) = na2so4(p-p) + 2h,0ж).
C = 13%
Объяснение:
Запишем уравнение реакции получения HF из NaF
Посчитаем кол-во в-ва NaF (оно равно массе деленной на молярную массу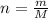 )
)
Так как кол-во в-ва NaF и HF равны, найдем массу HF (они равны, так как равны коэффициенты при формулах в уравнении реакции, это стехиометрический закон)
Процентная концентрация равна массе в-ва / массу р-ра (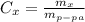 практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
Дано:
m (р-ра KI) = 415 г.
ω (KI) = 20% (0,2)
V (Cl₂) = 4,48 л.
Найти:
m (осадок)
• Запишем первую реакцию и уравняем её в случае необходимости:
2 KI + Cl₂ ===> 2 KCl + I₂
• По уравнению реакции: ν (KI) : ν (Cl₂) : ν (I₂) = 2 : 1 : 1
• Найдём массу и количество йодида калия:
ω (KI) = m (KI)/m (р-ра KI)
m (KI) = m (р-ра KI) • ω (KI) = 415 г. • 0,2 = 83 г.
ν (KI) = m/M = 83 г./166 г/моль = 0,5 моль
• Найдём количество хлора:
ν (Cl₂) = V/Vm = 4,48 л./22,4 л/моль = 0,2 моль
• Видим, что йодид калия находится в избытке, ⇒ ведём расчёты по хлору:
ν (I₂) = ν (Cl₂) = 0,2 моль
• Найдём массу йода:
m (I₂) = M • ν = 254 г/моль • 0,2 моль = 50,8 г.
• Запишем вторую реакцию:
I₂ + 2 AgNO₃ + H₂O ===> 2 AgI↓ + AgIO₃ + 2 HNO₂
• По уравнению реакции: ν (I₂) : ν (AgI) = 1 : 2
• Найдём количество йода:
ν (I₂) = m/M = 50,8 г./254 г/моль = 0,2 моль
• Найдём количество йодида серебра:
ν (AgI) = 2 • ν (I₂) = 2 • 0,2 моль = 0,4 моль
• Найдём массу осадка:
m (AgI) = M • ν = 235 г/моль • 0,4 моль = 94 г.
ответ: m (осадка) = 94 г.