Посчитаем кол-во в-ва NaF (оно равно массе деленной на молярную массу )
Так как кол-во в-ва NaF и HF равны, найдем массу HF (они равны, так как равны коэффициенты при формулах в уравнении реакции, это стехиометрический закон)
Процентная концентрация равна массе в-ва / массу р-ра ( практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
C = 13%
Объяснение:
Запишем уравнение реакции получения HF из NaF
Посчитаем кол-во в-ва NaF (оно равно массе деленной на молярную массу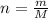 )
)
Так как кол-во в-ва NaF и HF равны, найдем массу HF (они равны, так как равны коэффициенты при формулах в уравнении реакции, это стехиометрический закон)
Процентная концентрация равна массе в-ва / массу р-ра (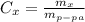 практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)