Так как нам даны и химические величины и физические, то уравнение, которое объединяет и химическое количество, и объем, и давление - уравнение Менделеева-Клайперона которое имеет следующий вид:
pV=nRT где p - давление, V - объем, n - химическое количество, R - газовая постоянная и Т - температура в Кельвинах.
Выразим из уравнения искомый объем - .
Так, переведем сразу же градусы в Кельвины: 25°С + 273.15= 298.15K
И переведем постоянную газовую, которая равна при именно атмосферном давлении - 0,082 атм·дм³/K·моль
Теперь, приведя все данные к одним размерностям можем расчитать сам объем метана - 1 моль·0,082атм·дм³/K·моль· 298.15K ÷ 2атм = 12,22 дм³
V(CH₄) = 12,22 дм³
Объяснение:
Мендлеева-Клапейрона и оно имеет следующий вид:
Так как нам даны и химические величины и физические, то уравнение, которое объединяет и химическое количество, и объем, и давление - уравнение Менделеева-Клайперона которое имеет следующий вид:
pV=nRT где p - давление, V - объем, n - химическое количество, R - газовая постоянная и Т - температура в Кельвинах.
Выразим из уравнения искомый объем -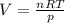 .
.
Так, переведем сразу же градусы в Кельвины: 25°С + 273.15= 298.15K
И переведем постоянную газовую, которая равна при именно атмосферном давлении - 0,082 атм·дм³/K·моль
Теперь, приведя все данные к одним размерностям можем расчитать сам объем метана -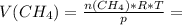 1 моль·0,082атм·дм³/K·моль· 298.15K ÷ 2атм = 12,22 дм³
1 моль·0,082атм·дм³/K·моль· 298.15K ÷ 2атм = 12,22 дм³