Дано:
t° = 37°C
m(KCl) = 5,875 гр
V(р-ра KCl) = 250 мл = 2,5×10⁻⁴ м³
R = 8,31 Дж/(моль×К)
-------------------------------------------------
Найти:
Pосм. - ?
1) Для нахождения осмотического давления мы находим по такой формуле:
Pосм. = Cm×R×T - осмотическое давление (1)
2) Для нахождения молярной концентраций мы найдем при такой формулы из количества молекул вещества на его объем раствора:
Cm = n/V(р-ра KCl) - молярная концентрация
n = m(KCl)/M(KCl) - количество вещества
Следовательно: Cm = m(KCl)/(M(KCl) × V(р-ра KCl)) - молярная концентрация (2)
3) Теперь мы из (2) формулы мы ставим в (1), тогда мы получим точную формулу для нахождения осмотического давления:
Pосм. = (m(KCl)×R×T)/(M(KCl) × V(р-ра KCl)) - осмотическое давление
4) Теперь мы находим осмотическое давление из этой формулы (только мы сначала мы найдем температуру в Кельвинах и молекулярную массу KCl):
T = t° + 273 К = 37 + 273 К = 310 К
M(KCl) = 39 + 35,5 = 74,5 гр/моль
Pосм. = (m(KCl)×R×T)/(M(KCl) × V(р-ра KCl)) = (5,875 гр × 8,31 Дж/(моль×К) × 310 К)/(74,5 гр/моль × 2,5×10⁻⁴ м³) ≈ (0,079 моль × 2576,1 Дж/моль)/(2,5×10⁻⁴ м³) ≈ (203,5119 Дж)/(0,00025 м³) ≈ (203,5119 (Н×м))/(0,00025 м³) ≈ 814047,6 Н/м² ≈ 814047,6 Па ≈ 8,14×10⁵ Па
ответ: Pосм. = 8,14×10⁵ Па, раствор KCl при Cm(KCl)= 0,32 моль/л гипотоничен плазме крови.
Решено от:
Дано:
t° = 37°C
m(KCl) = 5,875 гр
V(р-ра KCl) = 250 мл = 2,5×10⁻⁴ м³
R = 8,31 Дж/(моль×К)
-------------------------------------------------
Найти:
Pосм. - ?
1) Для нахождения осмотического давления мы находим по такой формуле:
Pосм. = Cm×R×T - осмотическое давление (1)
2) Для нахождения молярной концентраций мы найдем при такой формулы из количества молекул вещества на его объем раствора:
Cm = n/V(р-ра KCl) - молярная концентрация
n = m(KCl)/M(KCl) - количество вещества
Следовательно: Cm = m(KCl)/(M(KCl) × V(р-ра KCl)) - молярная концентрация (2)
3) Теперь мы из (2) формулы мы ставим в (1), тогда мы получим точную формулу для нахождения осмотического давления:
Pосм. = (m(KCl)×R×T)/(M(KCl) × V(р-ра KCl)) - осмотическое давление
4) Теперь мы находим осмотическое давление из этой формулы (только мы сначала мы найдем температуру в Кельвинах и молекулярную массу KCl):
T = t° + 273 К = 37 + 273 К = 310 К
M(KCl) = 39 + 35,5 = 74,5 гр/моль
Pосм. = (m(KCl)×R×T)/(M(KCl) × V(р-ра KCl)) = (5,875 гр × 8,31 Дж/(моль×К) × 310 К)/(74,5 гр/моль × 2,5×10⁻⁴ м³) ≈ (0,079 моль × 2576,1 Дж/моль)/(2,5×10⁻⁴ м³) ≈ (203,5119 Дж)/(0,00025 м³) ≈ (203,5119 (Н×м))/(0,00025 м³) ≈ 814047,6 Н/м² ≈ 814047,6 Па ≈ 8,14×10⁵ Па
ответ: Pосм. = 8,14×10⁵ Па, раствор KCl при Cm(KCl)= 0,32 моль/л гипотоничен плазме крови.
Решено от: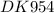
m(р-раH₂SO₄)=250г.
ω%(H₂SO₄)=25%
n(BaCO₃)=2,5моль
Vm=22,4л./моль
V(CO₂)-?
1. Определим массу чистой серной кислоты:
m₁(H₂SO₄)=ω%(H₂SO₄) х m(р-раH₂SO₄)÷100%
m₁(H₂SO₄)=25% х 250г.÷100%=62,5г.
2. Определим молярную массу серной кислоты и ее количество вещества в 62,5г.:
M(H₂SO₄)=1x2+32+16x4=98г./моль
n(H₂SO₄)=m(H₂SO₄) ÷ M(H₂SO₄)
n(H₂SO₄)=62,5г.÷98г./моль=0,64моль
3. Запишем уравнение реакции:
H₂SO₄ + BaCO₃ = BaSO₄ + CO₂ + H₂O
4. Анализируем уравнение реакции:
n(H₂SO₄)=1моль, n(BaCO₃)=1моль, n(CO₂)=1моль
5. По условию задачи:
n(H₂SO₄)=0,64моль, n(BaCO₃)=2,5моль, n(CO₂)=0,64моль
Делаем вывод, что карбонат бария дан в избытке.
6. Определим объем, образовавшегося оксида углерода(IV) количеством вещества 0,64моль:
V(CO₂)=n(CO₂)xVm
V(CO₂)=0,64моль х 22,4л./моль =14,3л.
7. ответ: при взаимодействии 250 г. раствора, содержащего 25 % серной кислоты с 2,5 моль карбоната бария образуется оксида углерода(IV) объемом 14,3л.