Гидроксид калия KOH (M=56 г/моль) будет реаг-ть только с гидрокарбонатом KHCO3 (M=100 г/моль): KOH + KHCO3 = K2CO3 + H2O; найдем кол-во в-ва KOH, а след-но и KHCO3 (см. ур-е р-ии): n KHCO3 = n KOH = (40*0.14)/56=0.1 моль, масса KHCO3 сос-т 100*0.1=10 г;
с учетом условия о м.д. K2CO3 (M=138 г/моль), найдем массу и кол-во в-ва K2CO3: m K2CO3 = (10*73.4)/26.6=27.594 г или 27.594/138=0.2 моль;
Ур-ия р-ий с серной к-ой:
2KHCO3 + H2SO4 = K2SO4 + 2CO2 + 2H2O и
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O, след-но объем CO2 сос-т 22.4*(0.1+0.2)=6.72 л.
Гидроксид калия KOH (M=56 г/моль) будет реаг-ть только с гидрокарбонатом KHCO3 (M=100 г/моль): KOH + KHCO3 = K2CO3 + H2O; найдем кол-во в-ва KOH, а след-но и KHCO3 (см. ур-е р-ии): n KHCO3 = n KOH = (40*0.14)/56=0.1 моль, масса KHCO3 сос-т 100*0.1=10 г;
с учетом условия о м.д. K2CO3 (M=138 г/моль), найдем массу и кол-во в-ва K2CO3: m K2CO3 = (10*73.4)/26.6=27.594 г или 27.594/138=0.2 моль;
Ур-ия р-ий с серной к-ой:
2KHCO3 + H2SO4 = K2SO4 + 2CO2 + 2H2O и
K2CO3 + H2SO4 = K2SO4 + CO2 + H2O, след-но объем CO2 сос-т 22.4*(0.1+0.2)=6.72 л.
CH₃COOH + C₂H₅OH = CH₃COOC₂H₅ + H₂O
1) Найдем количества каждого из реагирующих веществ, чтоб узнать, какое вещество дано в избытке:
M(CH₃COOH)=60 г/моль
M(C₂H₅OH)=46 г/моль
(уже, кстати, из молярных масс очевидно, что спирт дан в избытке, но мы все равно это проверим)
n(CH₃COOH)=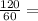 2 моль
2 моль
n(C₂H₅OH)=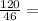 2,6 моль
2,6 моль
2) Расчет проводим по уксусной кислоте
M(CH₃COOH)=60 г/моль
M(CH₃COOC₂H₅)= 88 г/моль
m(CH₃COOH)= 120 г
m(CH₃COOC₂H₅)= х г
Расчет по уравнению реакции:
60 г CH₃COOH дают 88 г CH₃COOC₂H₅
120 г CH₃COOH дают х г CH₃COOC₂H₅
3) Найдем реальных выход эфира через пропорцию:
176 г - это 100% выхода
у г - это 80% выхода
ответ: можно получить 140,8 г эфира.