Треба приготувати 300г 5 % розчину сульфатної кислоти. Та в лабораторії є тільки 30% її розчин. Скільки цього розчину та води треба змішати, щоб одержати розчин необхідної концентрації ?
Найдем количество молей гидроксида меди. Количество вещества находится по формуле: , где m - масса вещества, M - молярная масса.
Молярная масса вещества находится из периодической таблицы, как сумма молярных масс входящих в него элементов.
Исходя из уравнения реакции для получения 0,1 моля гидроксида меди (II) должно быть использовано 0,2 моля гидроксида натрия и 0,1 моля сульфата меди (II).
т.е. потребуется 0,1 * (64+32 + 4 *16) = 16г сульфата меди (II) и
0,2 * (23 +16 + 1) = 8г гидроксида натрия.
Но гидроксид натрия дан в растворе. Масса раствора равна
n=m/M, n (СuО)=20/80=0,25 моль, n (СuSO4 )=(n (СuО)= 0,25 моль, m=n*М, m( СuSO4)=0,25*160=40 г(образовалось), кислоты затрачено m (Н2 SO4)= 0,25*98=24,5 г
Сколько воды после реакции: m р-ра= m (Н2 SO4)/w=24,5/0,4=61,25 г, m Н2О=61,25-24,5=36,75 г и 0,25*18=4,5 г воды образовалось по уравнению. Всего воды 36,75+4,5=41,25 г
На образование кристаллогидрата затрачивается х г СuSO4 и 90*х/160=0,5625*х г воды
х ………. (90*х/160)
СuSO4 + 5H2O = СuSO4*5H2O
160 …….. 5*18
В растворе остается: (40-х) г СuSO4 и (41,25-0,5625х) г H2O.
Найдем массу СuSO4, которая образовала кристаллогидрат при 20 градусах:
в 100 г H2O растворяется 20,9 г СuSO4.
а в (41,25-0,5625х) г H2O (40-х)
100*(40-х)=20,9*(41,25-0,5625х)
3137,875=88,244х
х=35,559 г СuSO4 образовала кристаллогидрат, это 35,559/160=0,22224 моль,
Уравнение реакции:
Найдем количество молей гидроксида меди. Количество вещества находится по формуле: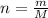 , где m - масса вещества, M - молярная масса.
, где m - масса вещества, M - молярная масса.
Молярная масса вещества находится из периодической таблицы, как сумма молярных масс входящих в него элементов.
Исходя из уравнения реакции для получения 0,1 моля гидроксида меди (II) должно быть использовано 0,2 моля гидроксида натрия и 0,1 моля сульфата меди (II).
т.е. потребуется 0,1 * (64+32 + 4 *16) = 16г сульфата меди (II) и
0,2 * (23 +16 + 1) = 8г гидроксида натрия.
Но гидроксид натрия дан в растворе. Масса раствора равна![\frac{8[g]}{0,04}=200[g]](/tpl/images/0923/0635/d3a92.png)
СuО +Н2SO4= СuSO4+H2O
n=m/M, n (СuО)=20/80=0,25 моль, n (СuSO4 )=(n (СuО)= 0,25 моль, m=n*М, m( СuSO4)=0,25*160=40 г(образовалось), кислоты затрачено m (Н2 SO4)= 0,25*98=24,5 г
Сколько воды после реакции: m р-ра= m (Н2 SO4)/w=24,5/0,4=61,25 г, m Н2О=61,25-24,5=36,75 г и 0,25*18=4,5 г воды образовалось по уравнению. Всего воды 36,75+4,5=41,25 г
На образование кристаллогидрата затрачивается х г СuSO4 и 90*х/160=0,5625*х г воды
х ………. (90*х/160)
СuSO4 + 5H2O = СuSO4*5H2O
160 …….. 5*18
В растворе остается: (40-х) г СuSO4 и (41,25-0,5625х) г H2O.
Найдем массу СuSO4, которая образовала кристаллогидрат при 20 градусах:
в 100 г H2O растворяется 20,9 г СuSO4.
а в (41,25-0,5625х) г H2O (40-х)
100*(40-х)=20,9*(41,25-0,5625х)
3137,875=88,244х
х=35,559 г СuSO4 образовала кристаллогидрат, это 35,559/160=0,22224 моль,
М(СuSO4*5H2O )=250 г/моль
Масса m СuSO4*5H2O= 0,22224 моль*250=55,56 г